Эти ферменты уже рассматривались нами в разных разделах. Основной материал распределился следующим образом: классификация ферментов, их специфичность — гл. 1, разд. В; структура активного центра, фермент-субстратный комплекс, ацилфермент и комплекс между ферментом и продуктом — гл. 1, разд. Г; кинетика-реакций и установление их механизма — гл. 7, разд. Б; рН-зависимость каталитического процесса и состояние ионизации активного центра — гл. 5, разд. Е и Ж.2.а; использование энергии связывания для увеличения са( — гл. 10, разд. А.4; стабилизация переходного состояния, специфическая сольватация переходного состояния — гл. 10, разд. В.5.в. В этом разделе вкратце рассмотрены все перечисленные вопросы.[ ...]
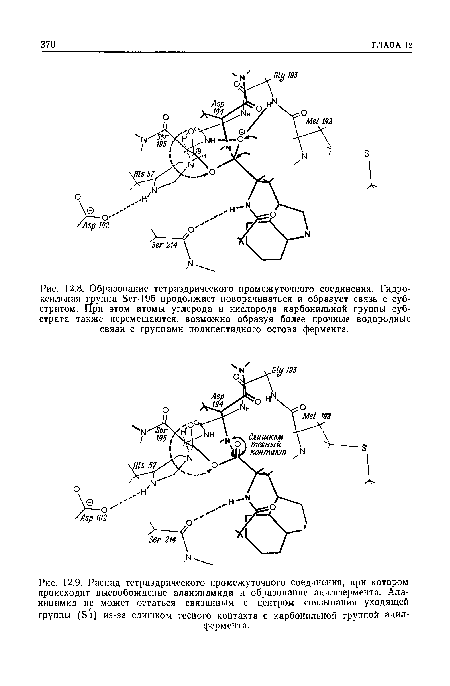
Для кристаллографов явилось полной неожиданностью выявление того факта, что карбоксильная группа Авр-102 также входит в состав активного центра с образованием каталитической триады, названной «системой с переносом заряда» [73].[ ...]
Как все эти факторы влияют на катализ — неизвестно. Было высказано предположение, что между Авр-102 и №в-57 в ходе реакции (12.22) происходит перенос протона [75].[ ...]
Кинетические и структурные данные позволяют качественно описать механизм ащилирования химотрипсина хорошим поли-пептидным субстратом [81].[ ...]
Несмотря на все эти подробности, многие важные аспекты механизма ацилирования все еще неясны. Например, мы не знаем, каким образом энергия связывания N-ациламино-фрагмента субстрата иногда используются для увеличения catj з не для уменьшения /См (табл. 10.1). Нам не известно, какой вклад в катализ вносит погруженный в белковую глобулу Asp-102, который входит в систему с переносом заряда (какой бы была активность химотрипсина, если бы аспартат был заменен аспарагином) .[ ...]
Рисунки к данной главе:
| Некоторые аминокислотные остатки химотрипсина, участвующие в |
 |