Многие вещества, обусловливающие мутность и цветность воды, находятся в ней в коллоидном состоянии. Для осветления и обесцвечивания воды в этом случае используются методы обработки, основанные на применении реагентов (коагулянтов), обеспечивающих перевод в осадок коллоиднодисперсных примесей и загрязнений. Коагулянты представляют собой соединения, способные гидролизоваться в воде с образованием различных коагуляционных структур, обладающих высокими адсорбционными и адгезионными свойствами.[ ...]
Коллоидные частицы загрязнений, сталкиваясь с хлопьями гидролизованного коагулянта, прилипают к ним или механически захватываются рыхлыми агрегатами хлопьев и вместе с ними выпадают в осадок. На поверхности хлопьев наряду с адгезией коллоидных частиц может происходить молекулярная адсорбция окрашенных органических примесей, а также хемосорбция загрязнений. Полнота и скорость осветления воды зависит как от свойств коагулянта, так и от свойств загрязняющих воду веществ.[ ...]
Таким образом, на поверхности твердой фазы формируется двойной электрический слой, внутреннюю обкладку которого составляют потенциалопределяющие ионы, а внешнюю — противоионы.[ ...]
В целом электронейтральный комплекс называется мицеллой.[ ...]
Прочность связи противоионов, входящих в состав двойного электрического слоя, с ядром мицеллы различна. Противоионы, находящиеся на очень близком расстоянии (порядка 1—2 молекул) от ядра, прочно удерживаются электростатическими и адсорбционными силами вблизи его поверхности. Остальные противоионы, отстоящие от ядра на большем расстоянии, преодолевают потенциальную энергию поля поверхности и благодаря молекулярному тепловому движению отдаляются от нее, образуя диффузную часть двойного слоя. Ядро и прочно связан ные с ним противоионы представляют собственно коллоидную частицу, несущую в отличие от мицеллы электрический заряд.[ ...]
При гидролизе растворов сернокислого алюминия потенциалопределя-ющими ионами и противоионами будут ионы А13+ и БС>1 соответственно.[ ...]
Существование плотной и размытой частей двойного слоя приводит к тому, что при движении частицы вместе с нею перемещаются только прочно связанные противоионы, тогда как противоионы диффузной части слоя движутся вместе с раствором. В результате этого твердые частицы и окружающая их жидкая среда приобретает разноименные заряды и в электрическом поле движутся в противоположные стороны. Граница, отделяющая часть двойного электрического слоя, которая движется вместе с частицей, от про-тивоионов, остающихся в растворе, называется границей скольжения.[ ...]
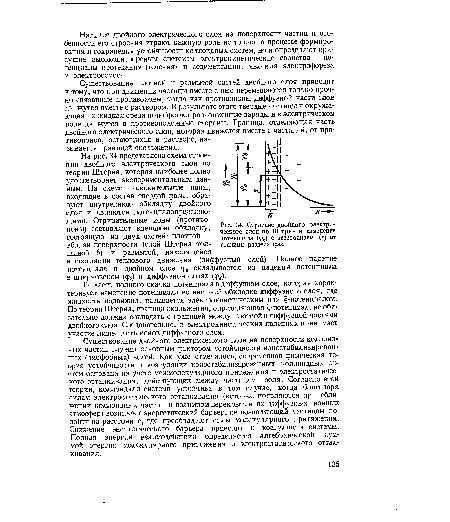
На рис. 34 представлена схема строения двойного электрического слоя по теории Штерна, которая наиболее полно удовлетворяет экспериментальным данным. На схеме положительные ионы, входящие в состав твердой фазы, образуют внутреннюю обкладку двойного слоя и являются потенциалопределяю-щими. Отрицательные ионы (противоионы) составляют внешнюю обкладку, состоящую из двух частей: плотной — вблизи поверхности (слой Штерна толщиной 6) и размытой, находящейся в состоянии теплового движения (диффузный слой). Полное падение потенциала в двойном слое ф0 складывается из падения потенциала в штерновском (фб) и диффузном слоях (ф ).[ ...]
Та часть полного скачка потенциала в диффузном слое, которая характеризует изменение потенциала во внешней обкладке диффузного слоя, где жидкость подвижна, называется электрокинетическим или 1-потенциалом. По теории Штерна, граница скольжения, определяющая -потенциал, не обязательно должна совпадать с границей между плотной и диффузной частями двойного слоя. Следовательно, в электрокинетических явлениях принимает участие лишь часть ионов диффузного слоя.[ ...]
Существование двойного электрического слоя на поверхности коллоидных частиц служит основным фактором устойчивости ионостабилизированных (лиофобных) золей. Как уже отмечалось, современная физическая теория устойчивости и коагуляции ионостабилизированных коллоидных систем основана на учете межмолекулярного притяжения и электростатического отталкивания, действующих между частицами золя. Согласно этой теории, коллоидная система устойчива в том случае, когда благодаря силам электростатического отталкивания (которые появляются при сближении коллоидных частиц и взаимном перекрытии их диффузных ионных атмосфер) возникает энергетический барьер, не позволяющий частицам подойти на расстояние, где преобладают силы молекулярного притяжения. Снижение энергетического барьера приводит к коагуляции системы. Полная энергия взаимодействия определяется алгебраической суммой энергии молекулярного притяжения и электростатического отталкивания.[ ...]
Рисунки к данной главе:
| Схематическое изображение мицеллы золя с положительно заряженной частицей. |
 |
| Строение двойного электрического слоя по Штерну и изменение потенциала (ф0) с расстоянием (х) от границы раздела фаз. |
 |
| Потенциальные кривые, характеризующие энергию взаимодействия (II) частиц в обычном ионостабилизированном золе в зависимости от расстояния (Н) между частицами |
 |
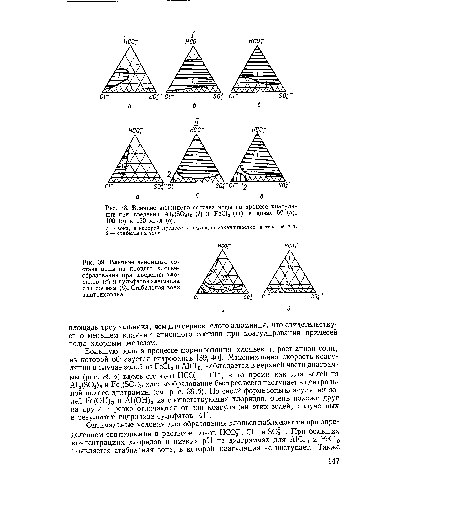
| Определение ионного состава с помощью треугольной диаграммы. |
 |
| Влияние анионного состава воды на процесс хлопье-обраэования при введении хлоридов (а) и сульфатов алюминия или железа (б). Стабильная зона заштрихована. |
 |
| Влияние анионного состав, воды на процесс коагуляции при очистке воды смесью РеС13-)-+ А12(504)з при их молярном отношении 3 |
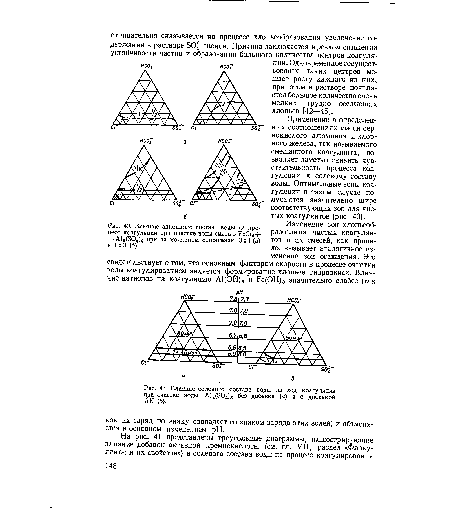 |
| Влияние солевого состава воды на ход коагуляции при очистке воды АЫБО,) без добавки (а) и с добавкой АК (б). |
 |
Аналогичные главы в дргуих документах:
| См. далее:Методы осветления и обесцвечивания воды с применением реагентов |