Многие вещества, обусловливающие мутность и цветность природных вод, относятся к числу коллоидных примесей. Кроме того, коллоиды образуются и в процессе очистки воды вследствие гидролиза вводимых в нее коагулянтов.[ ...]
Коллоидные примеси, находящиеся в природной воде, позволяют рассматривать ее как гетерофазную систему, в которой вода является дисперсионной средой, а масса распределенных в воде коллоидных частиц — дисперсной фазой. Эти частицы представляют собой очень мелкие агрегаты кристаллического строения. Благодаря огромной удельной поверхности коллоидных частиц последние обладают весьма значительной поверхностной энергией, а следовательно, и высокой адсорбционной емкостью. Это обстоятельство имеет большое значение, так как основной процесс обработки воды — коагулирование — связан с адсорбцией на коллоидных частицах примесей, содержащихся в воде.[ ...]
В зависимости от условий образования золя потенциалобразующие ионы и противоионы могут меняться местами.[ ...]
В некоторых случаях заряд коллоидных частиц образуется не за счет адсорбции ионов из раствора, а в результате диссоциации поверхностного слоя самого ядра, например при образовании коллоидной кремнекислоты. Молекулы БЮа, реагируя с водой, дают кремневую кислоту Н25Ю3 — слабый электролит с малой степенью диссоциации. Отрицательный заряд частицы ее обусловлен диссоциацией молекул Н25Ю3.[ ...]
В случае отрицательно заряженных частиц величина -потенциала зависит от катионов электролита, а положительно заряженных частиц — от анионов.[ ...]
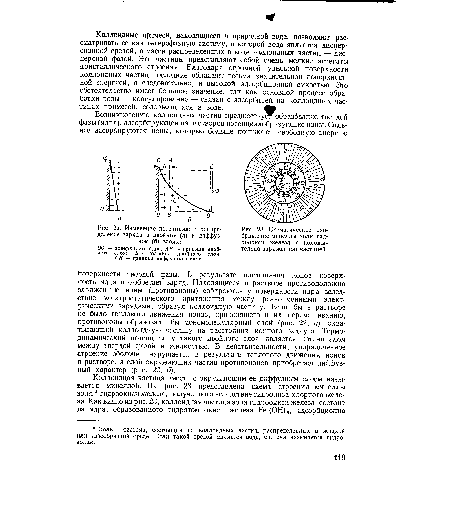
С прибавлением электролитов концентрация ионов в диффузном слое увеличивается и для компенсации зарядов на поверхности частиц требуется меньший объем диффузного слоя (т. е. происходит как бы его сжатие). Сжатие может дойти до такой степени, что диффузный слой не будет выходить за пределы линии, ограничивающей поверхность скольжения коллоидной частицы при ее движении (АВ на рис. 22, б). Когда диффузный слой сожмется до величины, ограниченной указанной линией, -потенциал станет равным нулю. В этот момент коллоидные частицы будут находиться в изоэлектрическом состоянии. В результате устраняются причины, препятствовавшие их сближению, коллоидные частицы, соединяясь, образуют сравнительно крупные агрегаты, которые начинают выпадать из раствора.[ ...]
При добавлении электролита к коагулируемому коллоиду можно заметить, что коагуляция начинается не в изоэлектрической точке, а при значении потенциала —0,03 в (значение -потенциала для большинства коллоидов обычно составляет 0,07 в). Это значение -потенциала является мерой устойчивости коллоидных систем; с его уменьшением снижается устойчивость коллоидных систем.[ ...]
АВ — поверхность . скольжения; СД — граница диффузного слоя при наиболее низкой концентрации электролитов; СЯД3 — граница диффузного слоя при наиболее высокой концентрации электролитов.[ ...]
Так выглядит коагуляция золей, обусловленная адсорбцией ионов и созданием двойного электрического слоя на поверхности коллоидных частиц. Их устойчивость в растворе определяется гидратацией ионов и влиянием зарядов поверэуюсти на ориентированную адсорбцию дипольных молекул воды. Эти гидратные слои полностью зависят от ионных взаимодействий и при электролитной коагуляции не препятствуют слипанию частиц. В таких типично гидрофобных золях после достижения пороговых концентраций электролитов наблюдаются явные признаки коагуляции, так как сжатие двойного электрического слоя и соответствующее уменьшение гидратных оболочек позволяет коллоидным частицам сближаться на расстояние, при котором энергия их взаимного притяжения превышает энергию теплового (броуновского) движения.[ ...]
Совершенно иной характер устойчивости золей при гидрофильной поверхности коллоидных частиц, которая обусловливает образование молекулярных сольватных слоев при участии вандерваальсовых, водородных и комплексных связей, вне зависимости от действия небольших концентраций электролитов. Так, В. А. Каргиным и 3. Я Берестневой было показано, что высокоочищенные золи кремневой кислоты и гидроокиси алюминия могут сохраняться в растворе даже при падении величины -потенциала почти до нуля [19].[ ...]
Рисунки к данной главе:
| Изменение потенциала и распределение заряда в двойном (а) и диффуз- |
 |
| Схематическое изображение мицеллы золя гидроокиси железа с положительно заряженной частицей. |
 |
| Влияние электролитов на электрокинетический потенциал |
 |
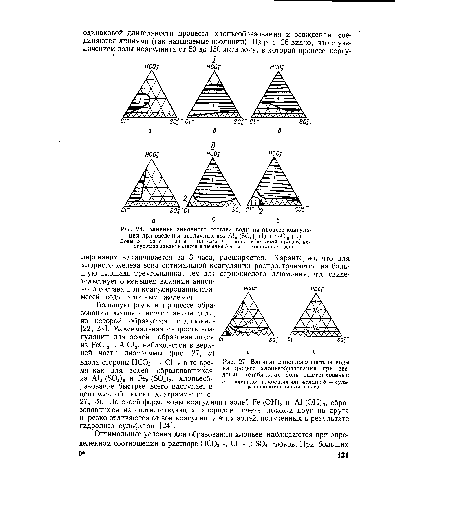
| Влияние анионного состава воды на процесс хлопьеобразования при введении (стабильная зона заштрихована) |
 |
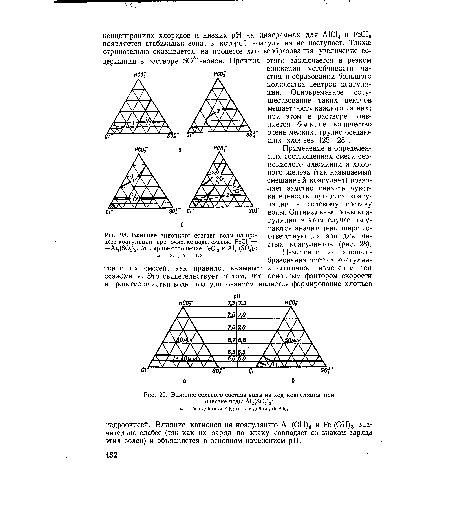
| Влияние солевого состава воды на ход коагуляции при очистке воды А1г(804)3 |
 |
Аналогичные главы в дргуих документах:
| См. далее:Методы осветления и обесцвечивания воды с применением реагентов |