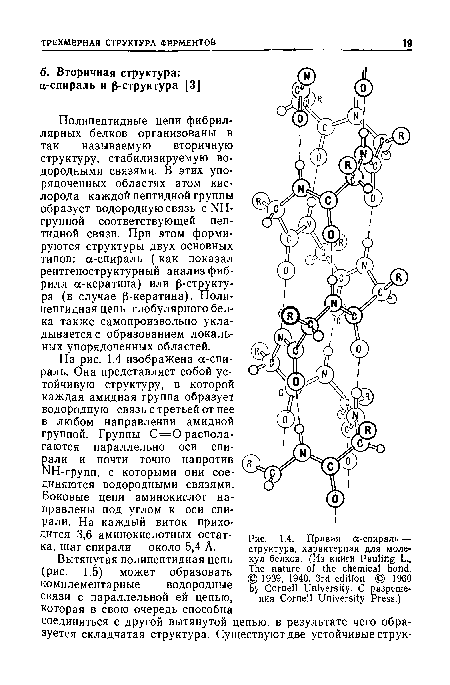
Полипептидные цепи фибриллярных белков организованы в так называемую вторичную структуру, стабилизируемую водородными связями. В этих упорядоченных областях атом кислорода каждой пептидной группы образует водородную связь с ИН-группой соответствующей пептидной связи. При этом формируются структуры двух основных типов: а-спираль (как показал рентгеноструктурный анализ фибрилл а-кератина) или р-структу-ра (в случае Р-кератина). Поли-пептидная цепь глобулярного белка также самопроизвольно укладывается с образованием локальных упорядоченных областей.[ ...]
На рис. 1.4 изображена а-спираль. Она представляет собой устойчивую структуру, в которой каждая амидная группа образует водородную связь с третьей от нее в любом направлении амидной группой. Группы С = 0 располагаются параллельно оси спирали и почти точно напротив ИН-групп, с которыми они соединяются водородными связями.[ ...]
Боковые цепи аминокислот направлены под углом к оси спирали. На каждый виток приходится 3,6 аминокислотных остатка, шаг спирали — около 5,4 А.[ ...]
Данные, полученные из статистического анализа и опытов с синтетическими полимерами, показывают, что одни аминокислоты предпочитают находиться в составе спирали, тогда как другие дестабилизируют эту структуру [5]. Например, пролин не может быть встроен в спираль без значительного нарушения ее структуры.[ ...]
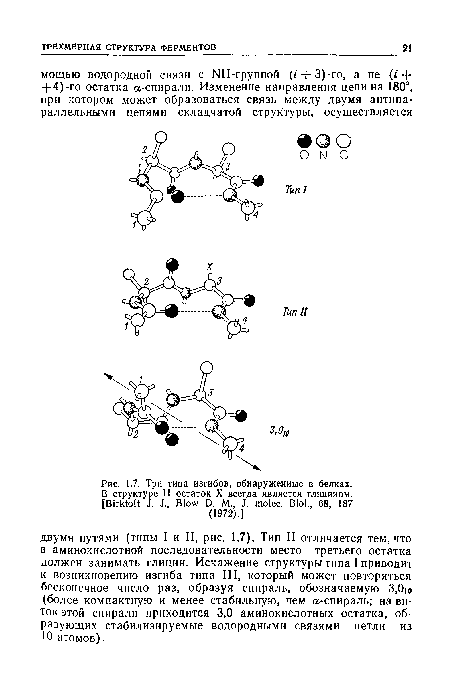
В структуре 11 остаток X всегда является глицииом.[ ...]
Рисунки к данной главе:
| Пептидная связь. Все расстояния даны в ангстремах [3], |
![Пептидная связь. Все расстояния даны в ангстремах [3],](/static/pngsmall/830604940.png) |
| Вытянутая полипептидная цепь. Водородные связи перпендикулярны плоскости рисунка, так что в результате наложения параллельных цепей друг на друга образуется Р-структура. |
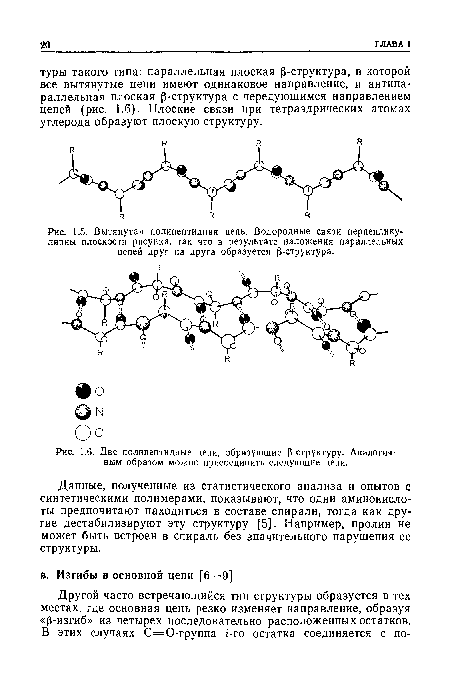 |
| Две полипептидные цепи, образующие (3-структуру. Аналогич-ным образом можно присоединить следующие цепи. |
 |
| Три типа изгибов, обнаруженные в белках. |
 |