Исходя из таких предпосылок процесс электролитической коагуляции можно разделить на следующие стадии: генерация ионов металла на поверхности электрода; миграция ионов металла с поверхности в объем раствора; образование малорастворимых соединений металла с компонентами раствора; адгезия коллоидных частиц примесей и образовавшихся малорастворимых соединений.[ ...]
Генерация ионов металла на поверхности электродов может происходить как при анодной, так и при катодной поляризации. Так, например, ионы алюминия генерируют на поверхности катода при высоких значениях pH прикатодного слоя [78]. Генерация ионов других металлов может быть осуществлена при создании определенных физико-химических характеристик прикатодного слоя.[ ...]
Данный механизм обобщает ряд схем анодного растворения металлов, в частности железа, предложенных Хойслером, Бокси-сом, Кристиансеном, Ротиняном и др. [32].[ ...]
При создании в приэлектродном слое условий, препятствующих диссоциации комплекса на простые ионы, а также при отсутствии механических воздействий, благоприятствующих отрыву молекулы от поверхности электрода (перемешивание жидкости, движение газовых пузырьков у электрода, вибрация электродов и т. п.), молекула закрепляется на поверхности за счет физических связей, образуя мономолекулярный, а затем и полимолеку-лярный слой. Электропроводность границы раздела такого слоя и поверхности электрода резко падает за счет отсутствия химических связей между кристаллической решеткой электрода и молекулами формирующего слоя, что приводит к резкому падению тока, проходящего через электродную ячейку.[ ...]
Как видно, условие (4) выполняется при выполнении условия (5) в связи с нарушением концентрационного равновесия молекул на поверхности электрода и в объеме приэлектрод-ного слоя.[ ...]
При низкой скорости диссоциации концентрация молекул в приэлектродном слое возрастает, что приводит к диффузии их с поверхности электрода. В этом случае решающим условием является условие (4), связанное с отводом образовавшихся молекул из приэлектродного слоя в объем раствора под воздействием механических или гидродинамических факторов. Для этих целей разработан ряд конструктивных мер, используемых на практике: ультразвуковая очистка электродов, вибрация, встряхивание, высокая скорость движения воды в межэлектродном пространстве при напорном режиме или за счет рециркуляции, однопоточная схема движения воды, механическая очистка электродов скребками, продувка межэлектродного пространства газом, вращающийся растворимый электрод и др.[ ...]
Однако во всех случаях устойчивость процесса анодного растворения определяется наличием таких специфических сорбирующихся ионов, которые на последней стадии обеспечивают высокую скорость диссоциации металла. Это подтверждается теоретически, например известными диаграммами Пурбе для железа (см. рис. 3.7) и алюминия [104], в которых указаны области пассивности металла, совпадающие с областями образования малорастворимых соединений продуктов растворения с компонентами раствора, а также практически, например для анодного растворения железа при рН<3, в присутствии повышенных концентраций хлоридов при pH = 3-М 0 и в других случаях.[ ...]
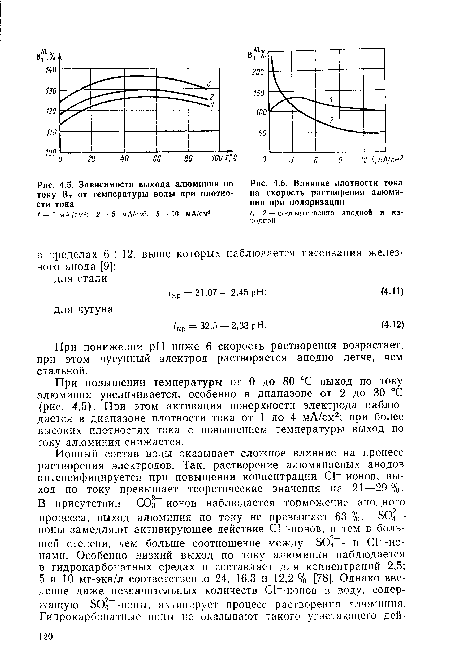
Соотношение между химическими и электрохимическими процессами растворения металлов существенно зависит от pH обрабатываемой воды. В нейтральной области pH химическое растворение алюминиевого анода составляет 20%, катода — 50%. электрохимическое растворение анода — 90—100 %. Суммарный выход по току минимален в диапазоне pH = 5-1-8 и резко возрастает в кислой и особенно щелочной средах, достигая 200 % [78].[ ...]
При понижении pH ниже 6 скорость растворения возрастает, при этом чугунный электрод растворяется анодно легче, чем стальной.[ ...]
Рисунки к данной главе:
| Влияние плотности тока на скорость растворения алюминия при поляризации 1, 2 — соответственно анодной и катодной |
 |