Конечно, невозможно получить сведения о У-структуре жидкости только с помощью одних термодинамических измерений. Это вызвано тем, что время, необходимое для типичного термодинамического измерения, значительно больше, чем интервал между диффузионными движениями молекул. Ранее уже была предложена структурная модель на основании других данных. Однако термодинамические свойства, связанные с этой моделью, могут быть вычислены методами статистической механики. Если же модель адэкватно описывает жидкость и если расчеты выполняются строго, тогда вычисленные свойства должны согласоваться с экспериментальными данными. К сожалению, действительно строгие расчеты для молекулы воды еще невозможны, и поэтому ее термодинамические свойства в настоящее время не могут быть использованы для подтверждения какой-либо конкретной модели жидкой структуры (см. раздел 5).[ ...]
Резкое увеличение энтальпии в точках плавления и кипения характеризует скрытую теплоту плавления и парообразования (см. табл. 3.7). Отметим, что внутренняя энергия плавления почти точно равна энтальпии плавления, но внутренняя энергия парообразования на 0,7 ккал/моль меньше, чем энтальпия парообразования, благодаря большому изменению объема при парообразовании.[ ...]
Точно так же внутренняя энергия, коэффициент расширения и сжимаемость жидкости могут быть выражены как сумма колебательного и конфигурационного вкладов.[ ...]
В противоположность теплоемкостям льда и пара, теплоемкость жидкой воды слишком большая, чтобы быть обусловленной целиком тепловым возбуждением механических степеней свободы. Это видно из следующего простого расчета. Хорошо известно, что каждая полностью возбужденная мода колебания вносит вклад Я в теплоемкость (см., например, [183]). Если каждая молекула в жидкой воде участвует в шести модах решеточных колебаний (три заторможенных трансляции и три либрации) (см. п. 4.7.3), тогда максимум теплоемкости жидкости, обусловленной колебаниями, составит 6Я = 11,9 кал/(моль •0 С), или только 2/з наблюдаемой теплоемкости. Действительно, теплоемкость, обусловленная колебаниями, определенно меньше 6Я, так как либрационные моды не полностью возбуждаются при комнатной температуре. Более того, если некоторые молекулы претерпевают свободное вращение и трансляцию вместо либраций и заторможенных трансляций, максимальная теплоемкость будет меньше, так как вращательные и трансляционные движения вместе могут внести максимальный вклад ЗЯ в теплоемкость.[ ...]
Ясно, что конфигурационный вклад в теплоемкость жидкой воды имеет тот же порядок величины, что и колебательный вклад, и обусловливает заметное увеличение теплоемкости в точке плавления. Он, несомненно, связан с искажением и, может быть, с разрывом водородных связей. Имея это в виду, рассмотрим теперь, как различные модели структуры воды объясняют наблюдаемую теплоемкость и связанные с пей свойства.[ ...]
Два параметра являются общими для большинства этих исследований— энергия, необходимая для разрыва водородной связи, и доля разорванных водородных связей в жидкости при данной температуре. Прокомментируем эти параметры и рассмотрим их значения (см. раздел 5). Мы найдем, что соответствующая интерпретация тепловой энергии воды может быть дана на основе разорванных водородных связей при условии, что математическая модель является достаточно гибкой в способе согласования параметров.[ ...]
Обозначим эту энергию через Ев. с...ж. Проблема определения Ев. о.-ж сходна с проблемой расчета энергии водородной связи во льду в соответствии с определением 4 (п. 3.6.1). Основная трудность состоит в том, что группа О—Н, не соединенная водородной связью в жидкости, еще взаимодействует с соседними молекулами с помощью дисперсионных и других сил и энергия этих взаимодействий не может быть вычислена каким-либо прямым способом. В самом деле, вероятно, что энергия этой реакции зависит от температуры и давления, так как энергия водородной связи чувствительна к окружению связи (см. п. 3.6.3). Различные методы были использованы для вычисления £п. с.-ж, и полученные величины находились в широком интервале значений (табл. 4.2). Каждый метод строился на операционном определении Ев. с. ж. Поэтому нет ничего неожиданного в том, что получены различные значения искомых величин (табл. 4.2) и не ясно, соответствует ли какая-либо из них энергии реакции, выражаемой уравнением (4.4).[ ...]
Даже спектроскопические расчеты доли разорванных водородных связей дают широкий интервал значений этой величины. Уэлрафен [370] по интенсивности т-полосы подсчитал, что свыше 80% водородных связей разрываются при 65° С, в то время как Уэлл и Горниг [368] оценили по интенсивности ур-полосы, что менее 5% водородных связей разрываются при той же температуре. Эти и другие спектроскопические исследования обсуждаются в подразделе 4.7.[ ...]
Различия в результатах вычислений как Ев. с.-ш, так и доли разорванных связей в жидкости могут иметь отношение к природе потенциальной энергии поверхности взаимодействия молекул воды. Форма этой поверхности может быть такой, что понятие «разорванная водородная связь» не является полезным для описания взаимодействий молекул воды в чистой жидкости (см. п. 4.8.1).[ ...]
Рисунки к данной главе:
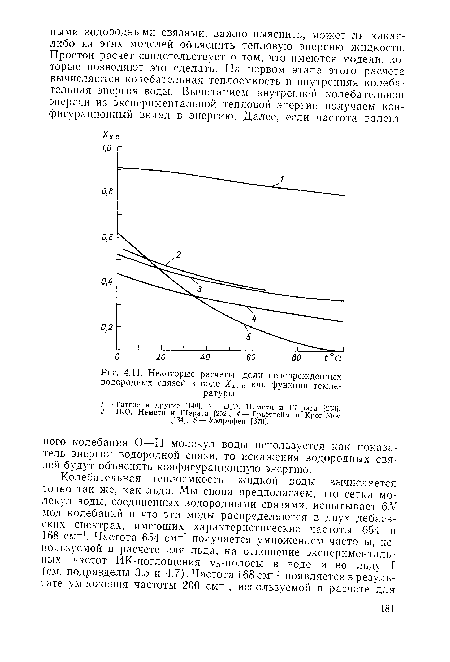
| Некоторые расчеты доли неповрежденных водородных связей в воде Хв. 0 как функции температуры. |
 |
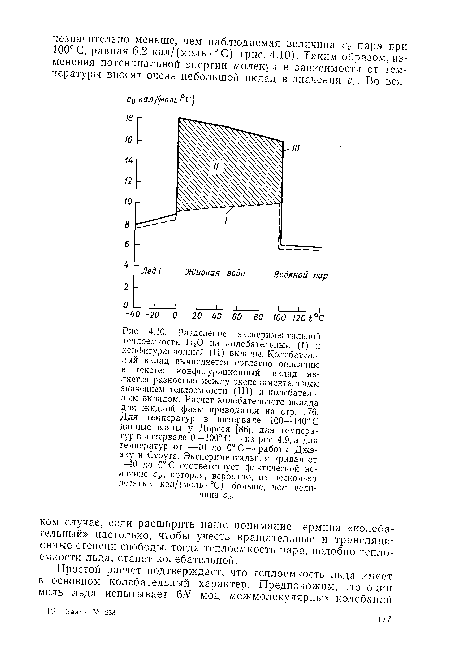
![Разделение наблюдаемой тепловой энергии волы на колебательный (/) и конфигурационный (//) вклады. Колебательный вклад был вычислен согласно описанию в тексте, а конфигурационный вклад— вычитанием колебательной энергии из наблюдаемой тепловой энергии. Спектроскопические данные для льда п жидкой воды получены Фалком и Фордом [104] и Бенедиктом и другими [19]. ///—экспериментальная энергия. 1—конфигурационная энергия, вычисленная с помощью уравнения (4.5) и экспериментальной валентной частоты связи О—Н. Валентная частота О—Н жидкой воды при 0° С вычислена путем экстраполяции данных Фалка и Фонда.](/static/pngsmall/318625268.png)