| Рентгенограмма кристалла а-химотрипсина, иллюстрирующая увеличение количества данных, необходимых для получения более высокого разрешения. |
 |
Далее
| Пептидная связь. Все расстояния даны в ангстремах [3], |
![Пептидная связь. Все расстояния даны в ангстремах [3],](/static/pngsmall/830604940.png) |
Далее
| Правая а-спираль — структура, характерная для моле кул белков. (Из книги Pauling L., The nature of the chemical bond. © 1939, 1940, 3rd edition © 1960 by Cornell University. С разрешения Cornell University Press.) |
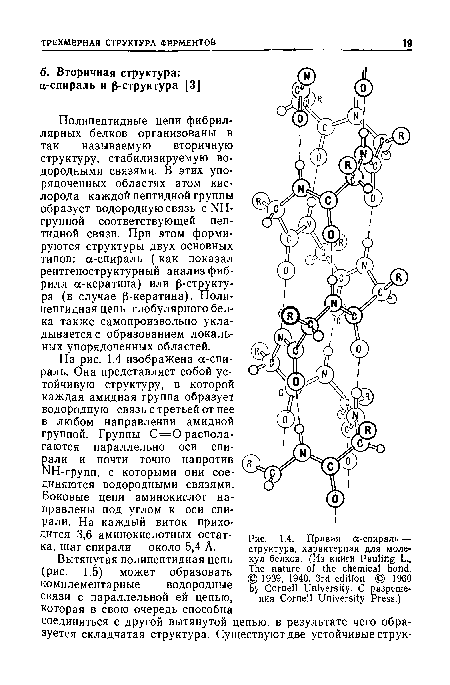 |
Далее
| Вытянутая полипептидная цепь. Водородные связи перпендикулярны плоскости рисунка, так что в результате наложения параллельных цепей друг на друга образуется Р-структура. |
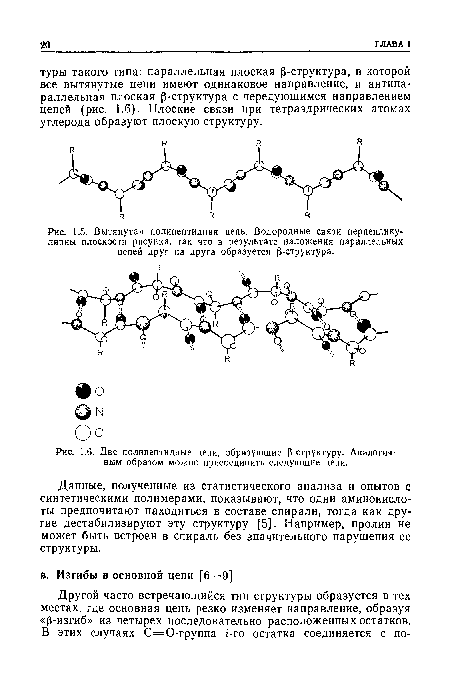 |
Далее
| Две полипептидные цепи, образующие (3-структуру. Аналогич-ным образом можно присоединить следующие цепи. |
 |
Далее
| Три типа изгибов, обнаруженные в белках. |
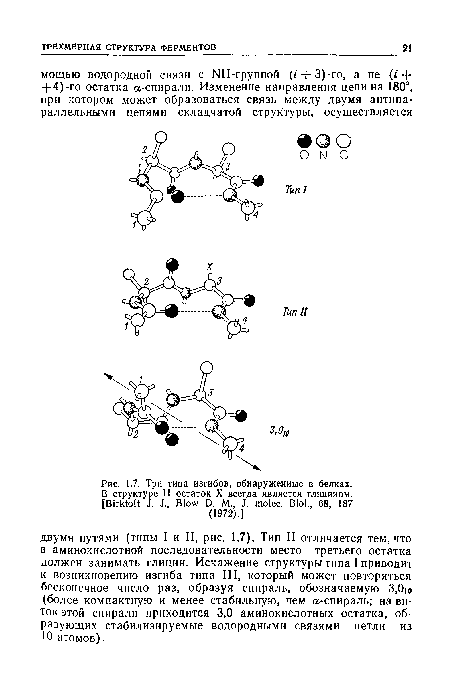 |
Далее
| Ленточные диаграммы полипептидных цепей химо-трипсина (А), эластазы (Б) и трипсина (В). «-Углеродные атомы располагаются на сгибах ленты. Небольшие различия имеются в структуре лишь внешних петель. (С любезного разрешения Smith J.) |
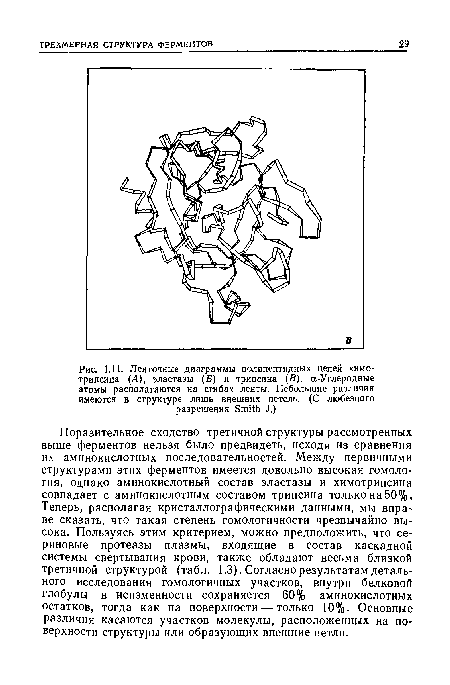 |
Далее
| Схематическое изображение участка связывания уходящей группы в химотрипсиие, полученное с помощью подгонки модели ингибитора панкреатического трипсина к структуре фермента [65]. |
![Схематическое изображение участка связывания уходящей группы в химотрипсиие, полученное с помощью подгонки модели ингибитора панкреатического трипсина к структуре фермента [65].](/static/pngsmall/830604984.png) |
Далее
| Полисахаридный субстрат лизоцима, обнаруженный в клеточных |
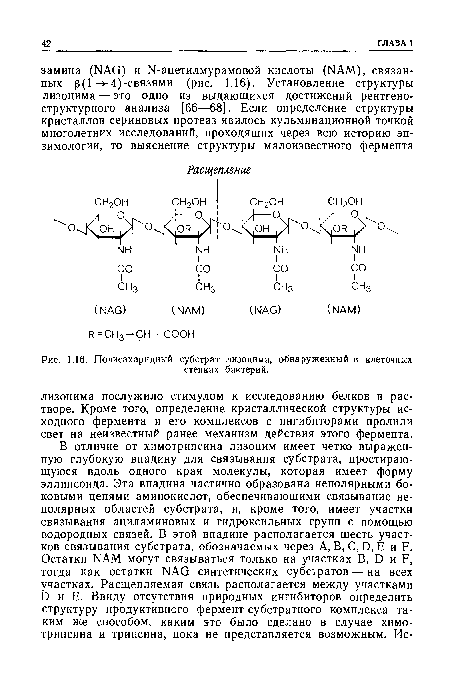 |
Далее
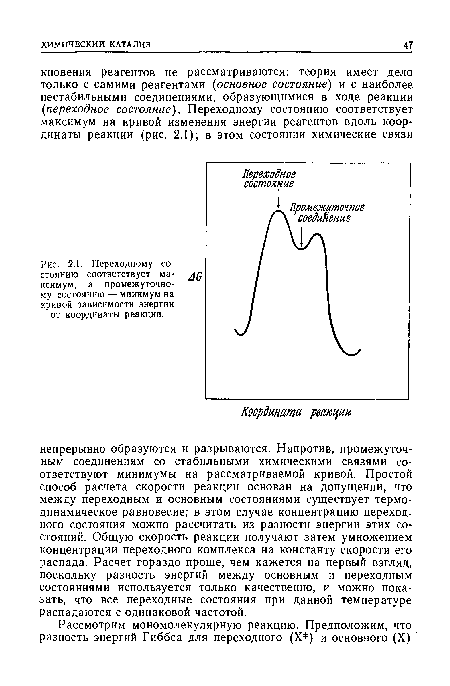
| Переходному состоянию соответствует ма- дд ксимум, а промежуточному состоянию — минимум на кривой зависимости энергии от координаты реакции. |
 |
Далее
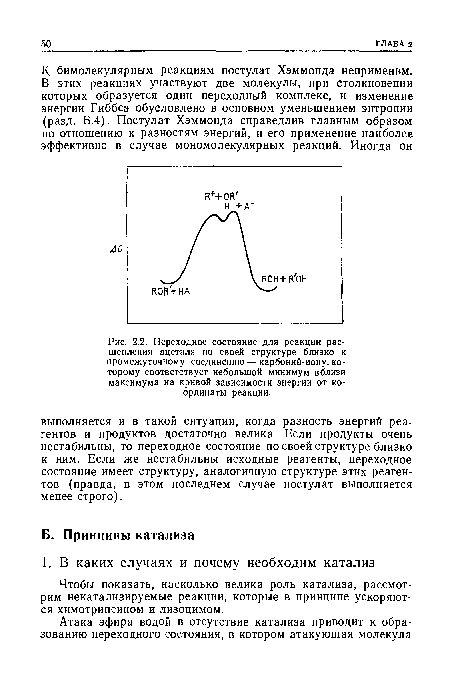
| Переходное состояние для реакции расщепления ацеталя по своей структуре близко к промежуточному соединению — карбоний-иону, которому соответствует небольшой минимум вблизи максимума на кривой зависимости энергии от координаты реакции. |
 |
Далее
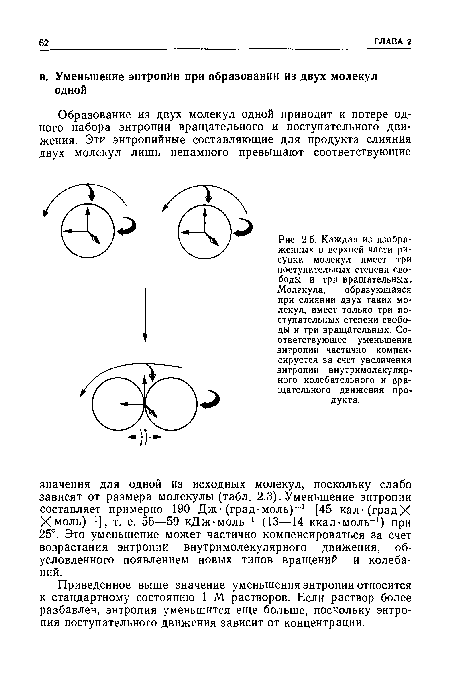
| Каждая из изображенных в верхней части рисунка молекул имеет три поступательных степени свободы и три вращательных. Молекула, образующаяся при слиянии двух таких молекул, имеет только три поступательных степени свободы и три вращательных. Соответствующее уменьшение энтропии частично компенсируется за счет увеличения энтропии внутримолекулярного колебательного и вращательного движения про- |
 |
Далее
| Изменение энергии при переносе водорода или дейтерия от атома углерода. Энергия переходного состояния в обоих случаях имеет одно и то же значение (этот вопрос обсуждается в тексте), однако в исходных веществах водород имеет более высокую энергию вследствие более высокой нулевой энергии. Следовательно, энергия активации при переносе водорода ниже, чем при переносе дейтерия. |
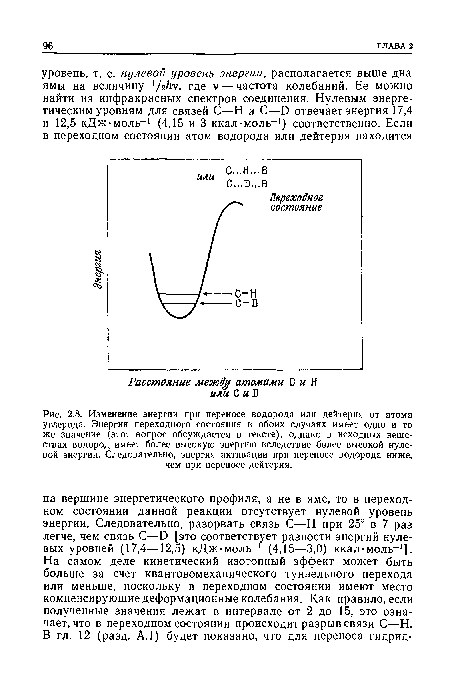 |
Далее
| Зависимость скорости реакции от концентрации субстрата для механизма Михаэлиса — Ментен. |
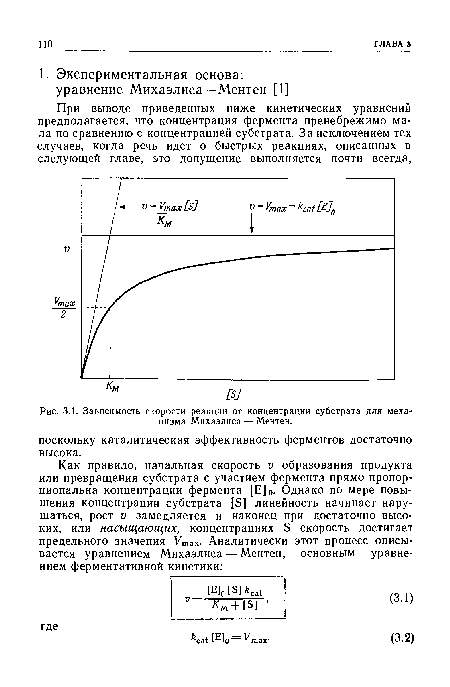 |
Далее
| Параллельные прямые на графике двойных обратных координат, характерные для механизма типа пинг-понг. При увеличении концентрации второго субстрата в указанной последовательности Vmsx возрастает, как и Км для первого субстрата. Параметр Утгх/Км — величина, обратная тангенсу наклона прямых, — остается постоянной. |
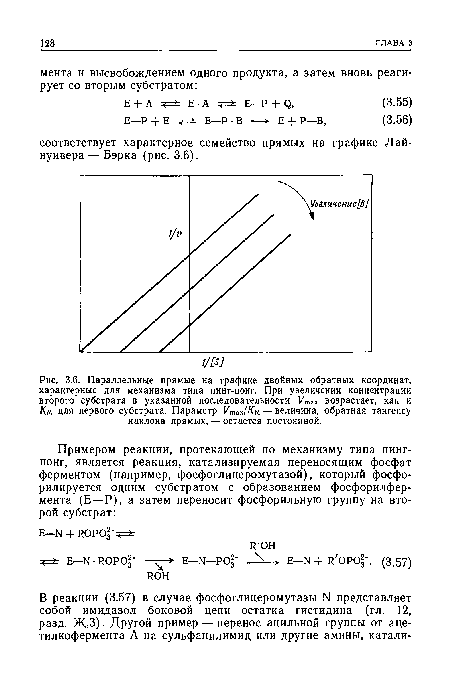 |
Далее
| Схема устройства, используемого в методе непрерывной струи. |
 |
Далее
| Схема устройства, используемого в методе остановленной струи. |
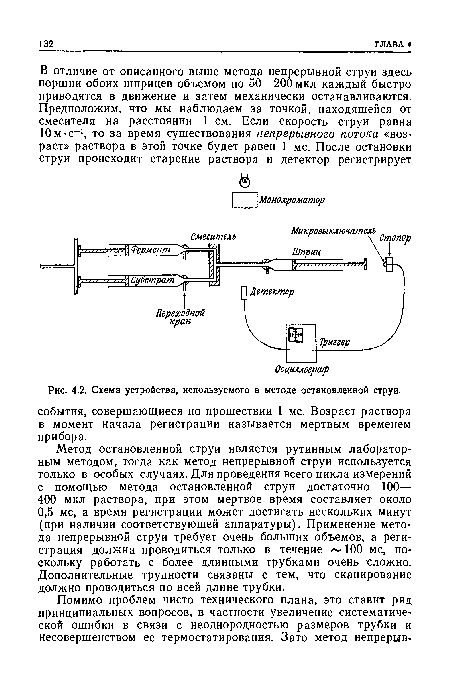 |
Далее
| Схема устройства, используемого в методе «замороженной» струи. |
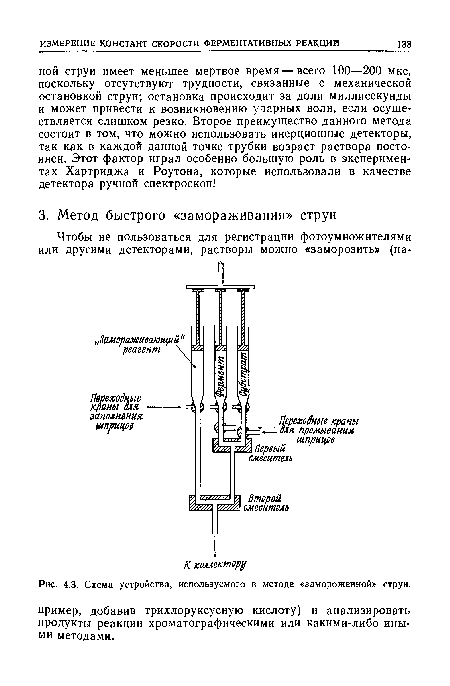 |
Далее
| Схема устройства, используемого в импульсном методе «замороженной» струи. |
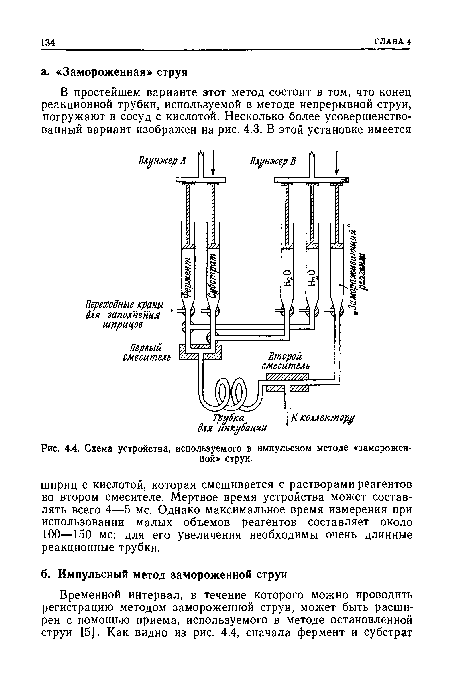 |
Далее
| Диаграмма, иллюстрирующая принцип метода температурного |
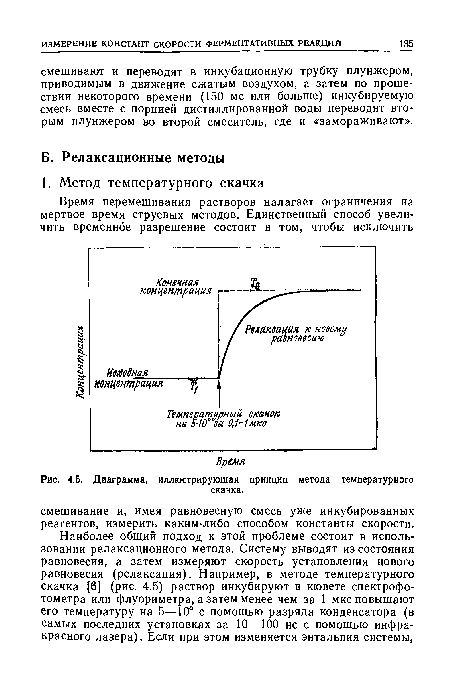 |
Далее
| Временные зависимости концентраций реагентов А, В и С для реакции А-»-В- -С [уравнение (4.28)]. А. к1 = 10 с-1, к2 = 1 с-1. £.¿1=1 с-1, ¿г = Ю с-1. Заметим, что а) ход кривых для [С] в обоих случаях одинаков; б) кривые для [В] имеют одинаковую форму и различаются только амплитудой; в) концентрация вещества А в первом случае уменьшается в 10 раз быстрее, чем во втором. Таким образом, если не измерять концентрацию А, то различить эти два случая только на основании определения констант скорости нельзя. |
![Временные зависимости концентраций реагентов А, В и С для реакции А-»-В- -С [уравнение (4.28)]. А. к1 = 10 с-1, к2 = 1 с-1. £.¿1=1 с-1, ¿г = Ю с-1. Заметим, что а) ход кривых для [С] в обоих случаях одинаков; б) кривые для [В] имеют одинаковую форму и различаются только амплитудой; в) концентрация вещества А в первом случае уменьшается в 10 раз быстрее, чем во втором. Таким образом, если не измерять концентрацию А, то различить эти два случая только на основании определения констант скорости нельзя.](/static/pngsmall/830605188.png) |
Далее
| График, показывающий невозможность дифференциации механизмов (4.69) и (4.72) с помощью уравнений (4.71) и (4.74). Приведена зависимость константы скорости для связывания профлавина а-химотрипсином при pH 6,84 и 25 °С от концентрации профлавина. Реакция протекает согласно следующему уравнению |
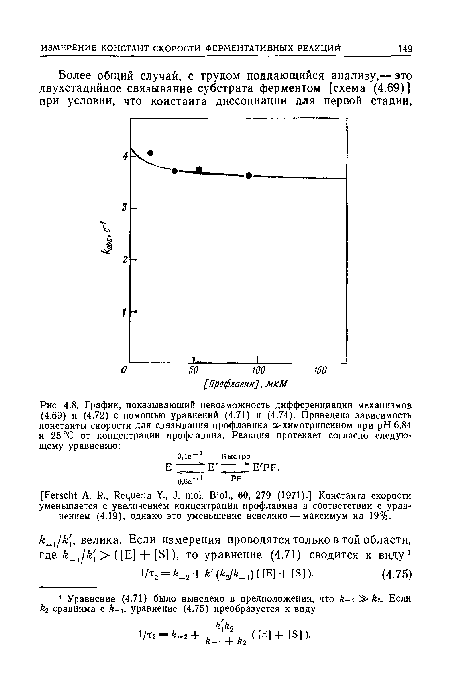 |
Далее
| Принцип титрования активных центров. |
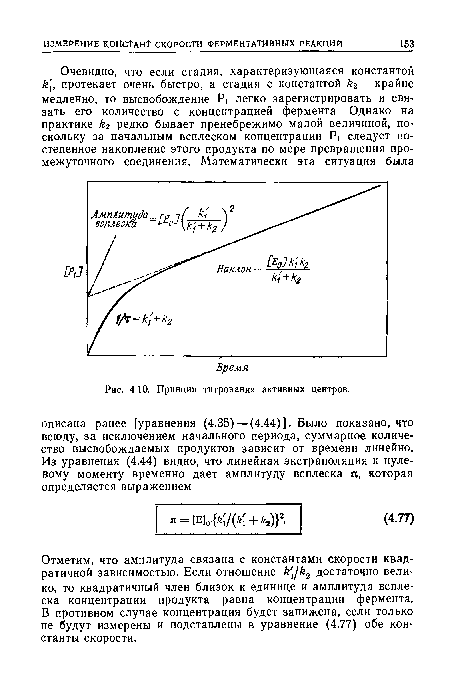 |
Далее
| Графики зависимости к0ы и ^&0ьв от pH для фермента, активного только в депротонированной форме кислоты с рда = 7. |
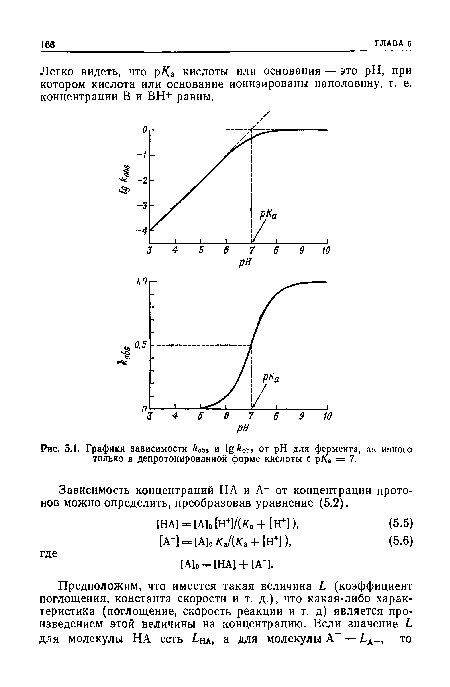 |
Далее
| Графический метод анализа кинетики реакции, подчиняющейся уравнению (6.9). График построен в координатах 0; 1п[В]}. Константа скорости медленного процесса определяется из наклона линейного участка кривой, когда быстрый процесс уже завершился. Константа скорости быстрого процесса определяется из графика зависимости 1п Д (разность между значением концентрации В в данный момент времени и значением, полученным экстраполяцией линейного участка, как показано на рисунке) от времени, построенного по начальным точкам кривой. Для рассматриваемого примера константы скорости равны 20 и 2 с-1. |
![Графический метод анализа кинетики реакции, подчиняющейся уравнению (6.9). График построен в координатах 0; 1п[В]}. Константа скорости медленного процесса определяется из наклона линейного участка кривой, когда быстрый процесс уже завершился. Константа скорости быстрого процесса определяется из графика зависимости 1п Д (разность между значением концентрации В в данный момент времени и значением, полученным экстраполяцией линейного участка, как показано на рисунке) от времени, построенного по начальным точкам кривой. Для рассматриваемого примера константы скорости равны 20 и 2 с-1.](/static/pngsmall/830605304.png) |
Далее
| Принцип равновесного диализа. |
 |
Далее
| Микроячейки, изображенные на рис. 6.4, смонтированные на вращающемся барабане для помещения их в термостат. |
 |
Далее
| Седиментация смеси тРНК и аминоацил-тРНК—синтетазы. Комплекс фермента с тРНК осаждается быстрее свободной тРНК. Свободный фермент и его комплекс с тРНК осаждаются вместе, поскольку находятся в состоянии быстро устанавливающегося равновесия. |
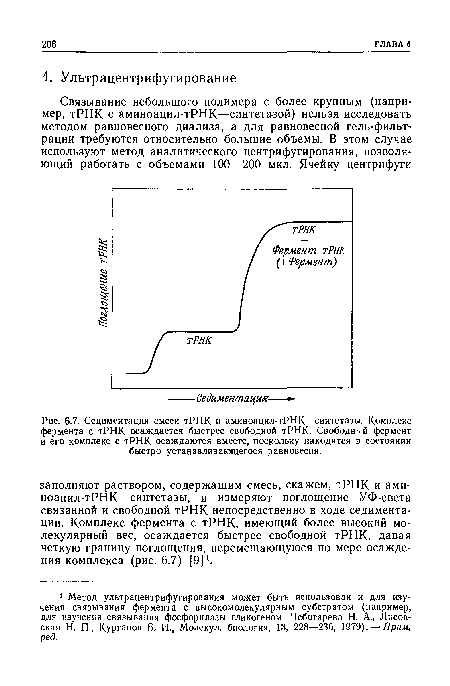 |
Далее
| Константы скорости процесса увеличения интенсивности флуоресценции фрагмента Si при смешивании с АТР, взятой в различных концентрациях; смешивание проводилось в устройстве, применяемом в методе остановленной струи [65]. |
![Константы скорости процесса увеличения интенсивности флуоресценции фрагмента Si при смешивании с АТР, взятой в различных концентрациях; смешивание проводилось в устройстве, применяемом в методе остановленной струи [65].](/static/pngsmall/830605386.png) |
Далее
| Связывание кислорода гемоглобином (/) и миоглобином (II). |
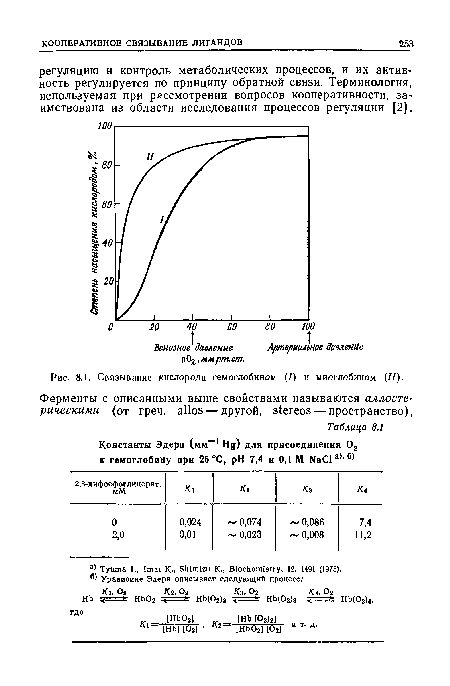 |
Далее
| График зависимости стехиометрии связывания v от v/[L] для процесса присоединения лигаида L к димерному белку. |
![График зависимости стехиометрии связывания v от v/[L] для процесса присоединения лигаида L к димерному белку.](/static/pngsmall/830605438.png) |
Далее
| Энергия взаимодействия между двумя атомами водорода и двумя (тетраэдрическими) атомами углерода в молекуле белка (по данным |
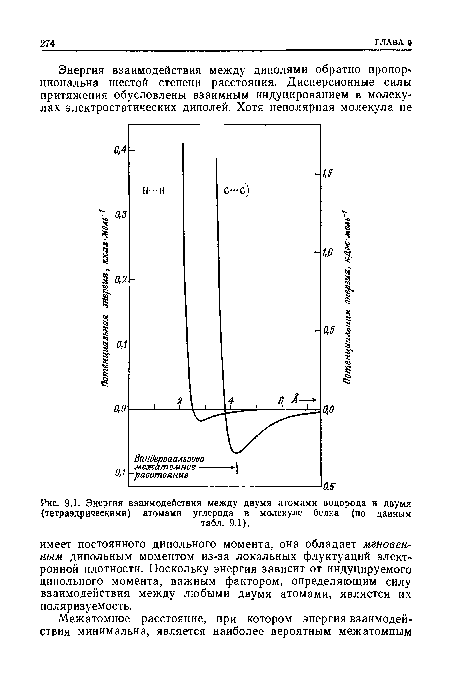 |
Далее
| Изменение энергии Гиббса для реакции |
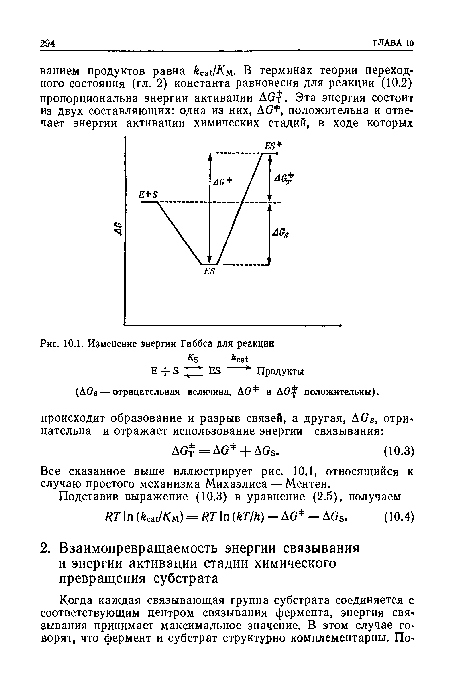 |
Далее
| Распределение гликолитических ферментов по значениям параметра |
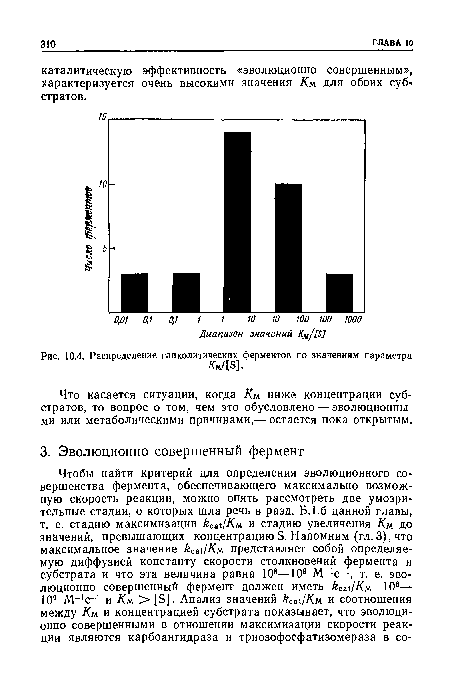 |
Далее
| Схематическое изображение процесса деформации по Холдейиу. Центр связывания фермента растягивает молекулу субстрата так, что ее структура приближается к структуре продукта и сжимает молекулу продукта, так что ее структура приближается в свою очередь к структуре субстрата. |
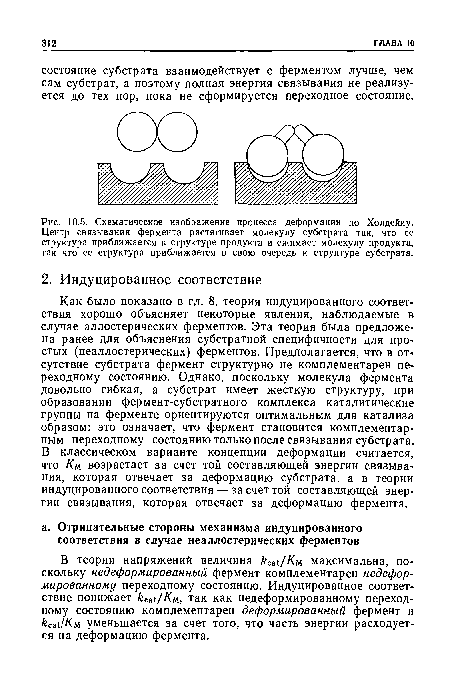 |
Далее
| Неправильное связывание анилидов, содержащих аномальный гидрофобный остаток, с гидрофобным центром связывания химотрипсина. |
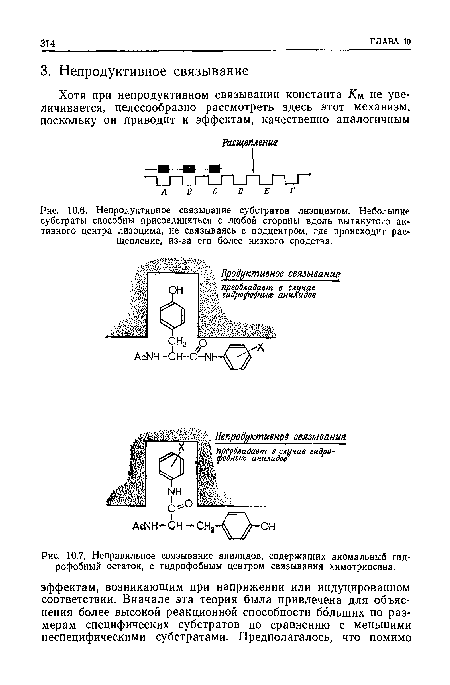 |
Далее
| Геометрические ограничения при ферментативном катализе, возникающие вследствие того, что катализатор (К) и сольватирующие группы (ЫН) являются составной частью фермента. Зачерненные конусы показывают допустимые углы орбитального перекрывания при образовании водородных связей; (1 — межатомное расстояние. Слева |
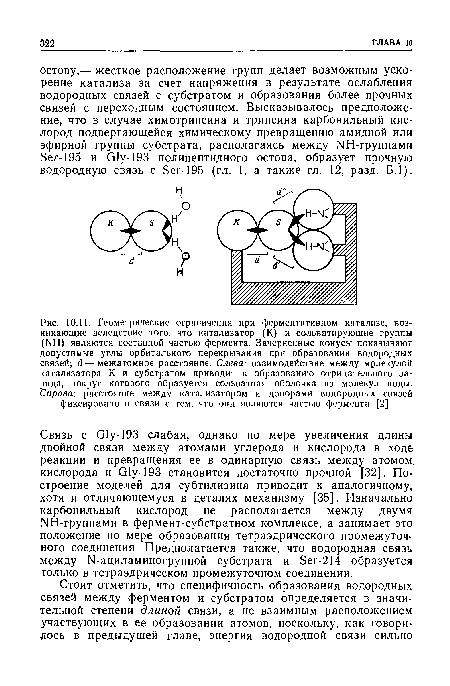 |
Далее
| Полость в активном центре изолейцил-тРНК — синтетазы способна связывать валин, поскольку она связывает больший по размеру изолейцин. Активный центр валил-тРНК — синтетазы не может «отторгнуть» треонин, так как он изостеричен валину. |
 |
Далее
| Одии из вариантов механизма «двойного сита», в котором стадия корректирования предшествует стадии переноса аминокислоты иа тРНК. |
 |
Далее
| В процессе синтеза молекулы белка происходит перемещение активированной по-липептидиой цепи к следующему амииокислотиому остатку. |
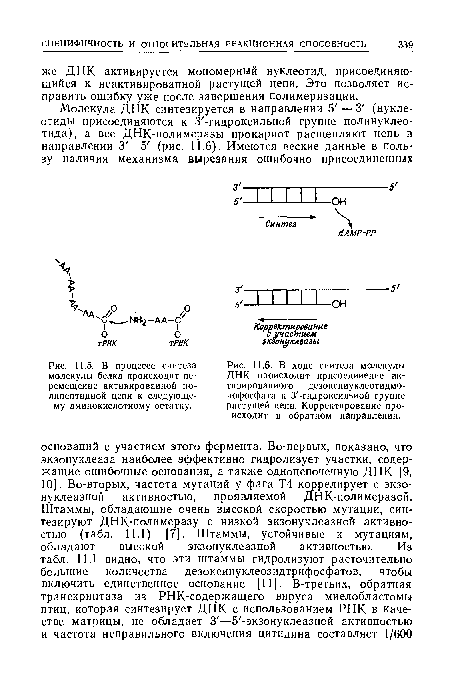 |
Далее
| Схематическое изображение активного центра алкогольдегидрогена зы из печени лошади. (С любезного разрешения С.-1. Вгапс1ёп.) |
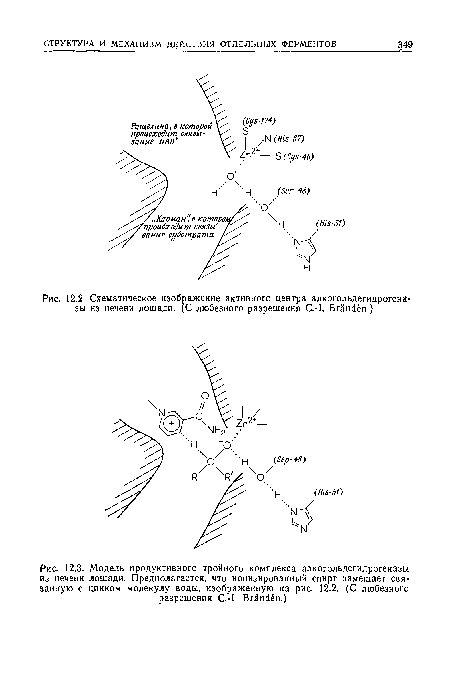 |
Далее
| Модель продуктивного тройного комплекса алкогольдегидрогеназы из печени лошади. Предполагается, что ионизированный спирт замещает связанную с цинком молекулу воды, изображенную на рис. 12.2. (С любезного разрешения С.-1. Вгапс!ёп.) |
 |
Далее
| Некоторые аминокислотные остатки химотрипсина, участвующие в |
 |
Далее
| Образование тетраэдрического промежуточного соединения. Гидроксильная группа Бег-195 продолжает поворачиваться и образует связь с субстратом. При этом атомы углерода и кислорода карбонильной группы субстрата также перемещаются, возможно образуя более прочные водородные связи с группами полипептидного остова фермента. |
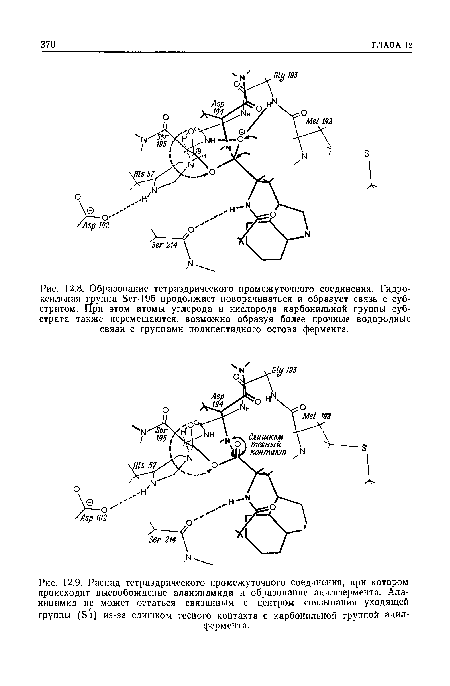 |
Далее
| Непродуктивный комплекс дипептида и карбоксипептидазы А. (С любезного разрешения Lipscomb W. Н.) |
 |
Далее
| Механизм действия глюкозо-6-фосфат—изомеразы, основанный на данных рентгеноструктурного анализа [252]. |
![Механизм действия глюкозо-6-фосфат—изомеразы, основанный на данных рентгеноструктурного анализа [252].](/static/pngsmall/830605724.png) |
Далее
