Высокая эффективная концентрация внутримолекулярных групп — один из наиболее важных факторов, обусловливающих эффективность ферментативного катализа. Теоретически это можно понять с позиций теории переходного состояния и из анализа энтропийного члена в уравнении (2.7) для константы скорости. Эффективные концентрации можно определить путем подстановки изменения энтропии в член ехр(Д5+/ ) уравнения (2.7).[ ...]
Смысл понятия «энтропия» (быть может, не совсем точно, но вполне удовлетворительно для данного контекста) можно сформулировать так: энтропия — это мера неупорядоченности системы. Чем неупорядоченнее система, тем больше вероятность ее существования и тем выше энтропия, Аналогичным образом энтропия связана с пространственной свободой атомов и молекул.[ ...]
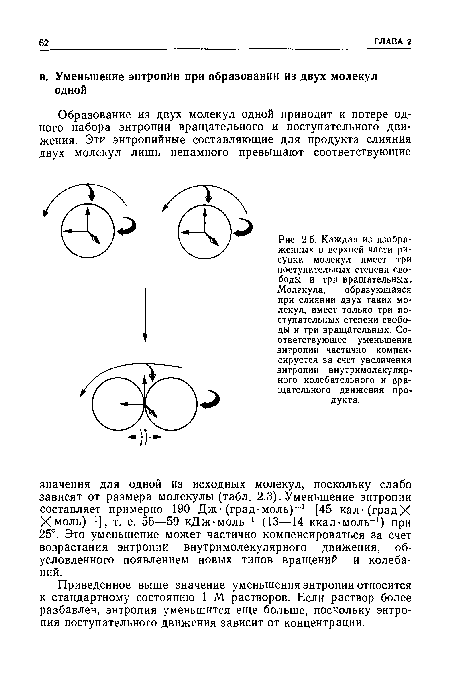
Преимущество внутримолекулярной реакции по сравнению с аналогичным межмолекулярным процессом с точки зрения катализа обусловлено энтропийным фактором. В межмолекуляр-ной реакции участвуют две или большее число молекул, а в результате образуется одна. Это ведет к возрастанию «порядка» и, следовательно, к уменьшению энтропии, Из уменьшения энтропии можно рассчитать «эффективную концентрацию».[ ...]
Энтропия молекулы — это сумма энтропий поступательного, вращательного и внутримолекулярного движений. Энтропию поступательного и вращательного движения можно точно рассчитать для молекулы вещества, находящегося в газообразном состоянии, из ее массы и геометрии. Энтропию колебательного движения рассчитывают из частот колебаний, а энтропию внутримолекулярного вращения — из энергетических вращательных барьеров.[ ...]
Для больших органических молекул энтропия поступательного движения также весьма велика—до 120 Дж-(град-•моль)-1 [30 кал-(град-моль)-1]. Она слабо растет с увеличением массы, но не зависит от концентрации.[ ...]
Приведенное выше значение уменьшения энтропии относится к стандартному состоянию 1 М растворов. Если раствор более разбавлен, энтропия уменьшится еще больше, поскольку энтропия поступательного движения зависит от концентрации.[ ...]
В соответствии с вышеизложенным образование переходного состояния АВ сопровождается уменьшением энтропии поступательного и вращательного движения. Внутримолекулярная циклизация [уравнение (2.23)] приводит лишь к небольшому уменьшению энтропии внутримолекулярного вращения. Однако уменьшение энтропии при образовании АВ частично компенсируется за счет некоторого увеличения энтропии внутримолекулярного вращения.[ ...]
В зависимости от относительного увеличения и уменьшения энтропии внутримолекулярного вращения при внутримолекулярной реакции увеличение энтропии может достигать 190 Дж-(град-моль)-1 [(45 кал-(град-моль)-1], или 55— 59 кДж-моль-1 (13—14 ккал-моль-1) при 25°. Это увеличение эквивалентно повышению эффективной концентрации соседней группы. Подстановка величины 190 Дж-(град-моль)-1 [(45 кал-(град-моль)-1] в энтропийный член уравнения (2.7) дает для максимальной эффективной концентрации соседней группы значение 6-109 М.[ ...]
Эти расчеты до конца справедливы только для газовой фазы. Однако до работы Пейджа и Дженкса вообще не предполагали, что реакции в растворе сопровождаются аналогичными изменениями энтропии, считая, что эффективная концентрация соседней группы достигает 55 М, т. е. концентрации молекул воды в воде. Это то значение, которое характерно для внутримолекулярного общего основного катализа.[ ...]
Рисунки к данной главе:
Вернуться к оглавлению