Люди интересовались водой с незапамятных времен. Еще в IV в. до н. э. Аристотель провозгласил воду началом всех вещей. В 1665 г. Гюйгенс предложил принять воду за опорные точки шкалы термометра, в 1780 г. Кавендиш, пропуская электрические искры в смеси кислорода и водорода, впервые синтезировал воду, а Лавуазье в 1783 г. вывел ее формулу.[ ...]
С тех отдаленных времен воду исследуют непрерывно — и физики, и химики, и биологи, и инженеры, каждый в своем аспекте. В результате выяспяется поистине грандиозная роль и огромная сложность воды. Геолог А. П. Карпинский имел все. основания написать, что «вода — это самое драгоценное ископаемое. Вода — это не просто минеральное сырье, это не только средство для развития промышленности и сельского хозяйства. Вода — эго действенный праздник культуры, это та живая кровь, которая создает жизнь там, где ее не было». Химик И. В. Пет-рянов-Соколов дал наиболее емкое определение воды, назвав ее самым необыкновенным веществом.[ ...]
Необыкновенность воды заключается главным образом в наличии многих аномальных, только ей присущих свойств. Почти все физико-химические свойства воды — исключение в природе, и только благодаря этим апомали-ям воды, как ни странно, возможна жизнь на нашей плачете.[ ...]
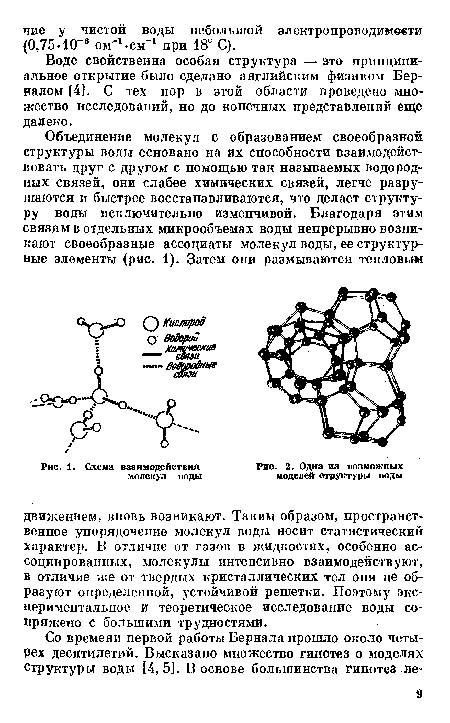
Воде свойственна особая структура — это принципиальное открытие было сделано английским физиком Берналом [4]. С тех пор в этой области проведено множество исследований, но до конечных представлений еще далеко.[ ...]
Так обстоит дело с чистой водой. Но ситуация крайне осложняется присутствием в воде примесей разного рода.[ ...]
Вообще говоря, вода без примесей практически немыслима. Она обладает аномально высокой диэлектрической проницаемостью — в 82 раза большей, чем воздух. Следовательно, если поместить в воду твердое тело, то взаимо-сцепление составляющих его разноименных зарядов, молекул и атомов уменьшится в 82 раза и они легко перейдут в раствор. Вода жадно растворяет в себе стенки сосудов, газы воздуха — вообще все, с чем она соприкасается. Даже в дождевой капле растворены газы и соли: выпарив 30 кг дождевой воды, можно получить 1 г сухого остатка. Высокая растворяющая способность воды — подлинное счастье для человечества. Например, только благодаря этому свойству вода доставляет питание корням растений и участвует во многих других биологических и технологических процессах.[ ...]
Все изменения структуры воды, вызываемые появлением в ней иона, принято делить на «ближнюю» и «дальнюю» гидратацию. Под первой понимается взаимодействие иона с ближайшими к нему молекулами воды. Дальняя гидратация заключается в поляризации под действием поля ионов молекул воды, не входящих в его ближайшее окружение. Обобщая и анализируя большой экспериментальный материал, О. Я. Самойлов ввел понятие положительной и отрицательной гидратации ионов. В первом случае ионы довольно устойчиво связаны с ближайшими к ним молекулами воды. При отрицательной гидратации молекулы воды вблизи ионов становятся более подвижными, чем в чистой воде. Это сложное явление обычно анализируется при условном делении гидратной оболочки на два слоя.[ ...]
Гидратация ионов зависит от их природы. Например, катионы щелочных и щелочноземельных элементов, а также анионы хлора, брома, иода и некоторые другие связывают молекулы воды непрочно (обладают, по О. Я. Самойлову, отрицательной гидратацией). Есть мнение, что в зависимости от температуры одни и те же ионы могут обладать как положительной, так и отрицательной гидратацией.[ ...]
Большое влияние на структуру воды оказывают примеси, находящиеся в молекулярной форме (неэлектролиты), а также молекулы газов. Они входят в пустоты каркаса и в зависимости от своих размеров стабилизируют или разрушают структуру. Процесс растворения в воде газов и других неэлектролитов состоит из двух этапов: создания в воде полости подходящего размера и внедрения в эту полость молекул растворяющегося вещества. При растворении инертных газов вокруг внедрившейся в воду молекулы в зависимости от ее размеров могут образовываться структуры типа льда, структуры с изогнутыми водородными связями или кристаллогидраты (газгидраты). Последние сами по себе весьма интересны.[ ...]
Твердые газгидраты являются очень прочным образованием из газа и воды. По виду они напоминают снег. Геологи установили, что газгидраты образуют газовые месторождения, нефтехимики и газовики отмечают, что углеводородные газгидраты забивают трубы и аппаратуру. В обычных условиях они в воде, по-видимому, отсутствуют. Это обстоятельство является хорошей иллюстрацией того, сколь большим может быть влияние па структуру воды молекул газов, входящих в ее полости. Не исключено, что при обычных температуре и давлении в воде могут находиться разобщенные элементы газгидратов.[ ...]
Рисунки к данной главе:
| Схема взаимодействия молекул воды |
 |