Современное понимание свойств озонного слоя основано на знании управляющих образованием и разрушением озона реакций и на учете переносящих его потоков воздуха; горизонтальных и вертикальных. Для того чтобьь оценить роль обоих факторов, следует достаточно аккуратно знать скорость этих реакций, так же как масштабы и скорость интересующих нагс атмосферных течений.[ ...]
В этом разделе мы займемся .главным образом фотохимической теорией озонаТ Мы изберем несколько упрощенный и сокращенный-ее вариант, учитывающий новейшие точки зрения на взаимодействие озона со многими малым»-примесями атмосферы и в то же время оставляющий в стороне менее важные реакции и процессы. Мы покажем, дто выбранный так путь вполне оправдывается полученными из фотохимической теории ясными физическими результатами.[ ...]
Вместе с тем мы покажем, что, например, рассмотренная-нами в 1973 г., [103] система уравнений «кислородно-водородной» теории должна быть дополнена группой более сложных реакций. Эти реакции важны не только для оценки баланса озона, но и для изучения процессов его переноса. Такая расширенная система уравнений определяет, в частности, и нижнюю границу той области, где фотохимические реакции достаточно быстры, чтобы брать верх над динамическими эффектами переноса, по крайней мере по отношению к озону .[ ...]
О некоторых из этих малых составляющих мы скажем подробнее ниже, касаясь реакций, в которых они участвуют. Хотя число таких возможных реакций между упомянутыми молекулами превышает 200, мы изучим тут лишь наиболее важные из них, стремясь главным образом к пониманию основного фотохимического процесса. В выборе таких реакций мы будем следовать Джонстону [194], используя, однако, ряд дополнительных новых сведений о газах атмосферы.[ ...]
Примечание. 2(10) означает концентрацию 21010 мол/см3. Через М обозначена полная концентрация всех молекул воздуха.[ ...]
Естественными источниками многих азотных к углеродных соединений в атмосфере являются болотный газ — метан СН4 и закись азота Ы20. Это очень постоянные составляющие атмосферы, они образуются главным образом в почве, перемешиваются в воздухе тропосферы и распространяются из нее (частично разрушаясь) в стратосферу. При нормальном давлении и температуре весь метан атмосферы образовал бы слой толщиной 1,16 см, а М20— 0,28 см (озон дал бы 0,30 см). Водяной пар присутствует, как известно, в большом количестве в воздухе тропосферы, но в стратосфере, по еще невыясненной физической .причине; его количество очень мало — около 2,7 10“6 долей по отношению к воздуху. Его концентрация там сравнима с концентрацией озона. Упомянутая в табл. 1.1 окись углерода СО (0,11 см), по-видимому, мало озоноактивна (рис. 1, 2, 3).[ ...]
Примечание. 2(10) означает концентрацию 2♦ 1010 мол/см3; 6—9 означает от 1(6) до 1(9).[ ...]
Эти данные о температуре могут,быть полезны для расчета констант тех фотохимических реакций, которые сильно зависят от Т.[ ...]
Рисунки к данной главе:
| Вертикальное распределение метана СН4 в тропосфере и стратосфере в миллионных долях по объему (ррти) по наблюдениям 1977 г. в ФРГ на высотах 0—35 км; Т — тропопауза |
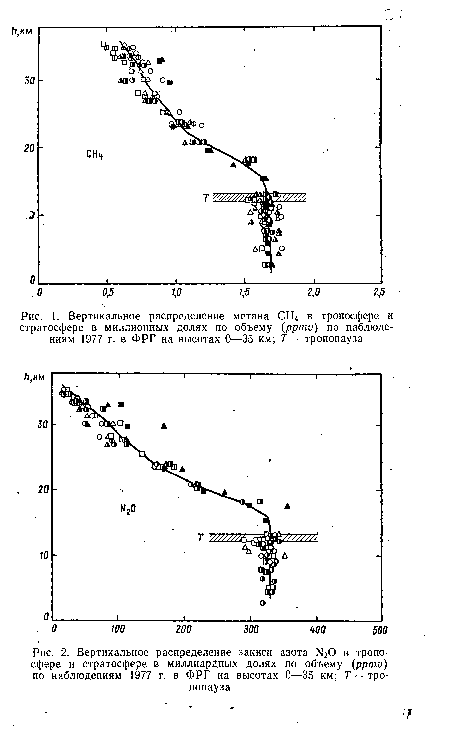 |
| Вертикальное распределение закиси азота- Н20 в тропосфере и стратосфере в миллиардных долях по объему (ррти) по наблюдениям 1977 г. в ФРГ на высотах 0—35 км; Г —тропопауза |
 |