Кроме того, в прикатодной зоне за счет подщелачивания раствора формируются кристаллы СаС03, CaS04, Mg(OH)2, которые, взаимодействуя с подложкой (электродом), образуют кристаллические осадки.[ ...]
Рассмотрим образование металлического кристалла на инертном катоде. При отсутствии поляризации раствор находится в равновесии с электродом и повышение концентрации восстанавливаемого иона приведет к образованию кристалла соли в растворе в соответствии с законами химического равновесия. Для появления зародыша кристалла на электроде необходимо, чтобы произошло восстановление иона, т. е. электродный процесс.[ ...]
Выражения (4.27) и (4.28) показывают, что рост поляризации (Дф) уменьшает работу образования зародыша и повышает вероятность его возникновения.[ ...]
Рост кристаллов происходит в соответствии со схемой (рис. 4.28) сравнительно толстыми слоями, видимыми в микроскоп. Обычно новый слой возникает у вершины (угла) кристалла и оттуда распространяется по поверхности примерно с постоянной скоростью. Движение раствора может вызывать искривление фронта роста слоев, что указывает на влияние изменения концентрации раствора у фронта роста. Существенную роль на рост кристаллов оказывает адсорбция посторонних примесей на поверхности электрода. Так, при перерывах в электроосаждении возможна пассивация электрода посторонними примесями с последующим нарушением образования слоя осадка при включении тока. С учетом сложного состава природных и сточных вод представляет интерес совместное восстановление катионов на катоде.[ ...]
При совместном разряде нескольких видов ионов скорости восстановления каждого из них отвечает определенная плотность тока [100], вследствие чего выход по току требуемой реакции определяется как Вт = г’!Дэ, где ¡э — эффективная плотность тока на электроде.[ ...]
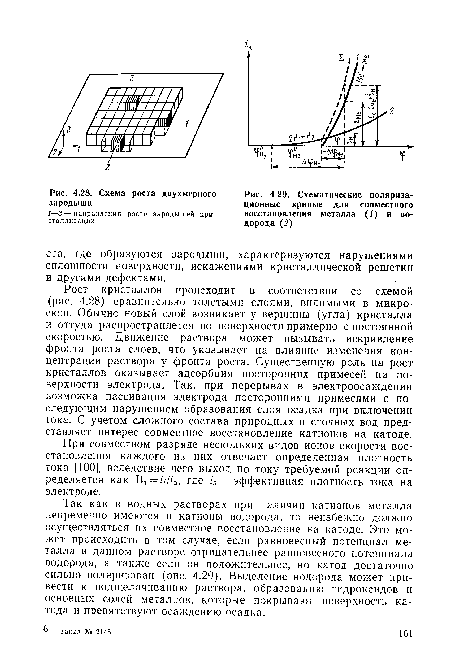
Так как в водных растворах при наличии катионов металла непременно имеются и катионы водорода, то неизбежно должно осуществляться их совместное восстановление на катоде. Это может происходить в том случае, если равновесный потенциал металла в данном растворе отрицательнее равновесного потенциала водорода, а также если он положительнее, но катод достаточно сильно поляризован (рис. 4.29). Выделение водорода может привести к подщелачиванию раствора, образованию гидроксидов и основных солей металлов, которые покрывают поверхность катода и препятствуют осаждению осадка.[ ...]
При совместном разряде двух или нескольких металлов суммарные поляризационные кривые зависят от поляризационных кривых каждого металла (рис. 4.30). В некоторых случаях, когда на электроде образуется сплав двух металлов, суммарная поляризационная кривая может не быть суммой поляризационных кривых отдельных металлов.[ ...]
Процесс электрокристаллизации широко применяется при извлечении металлов из сточных вод гальванических цехов [102]. Концентрированные медь-, никель-, цинкосодержащие электролиты направляют в электролизную бездиафрагменную ванну, где в качестве анода используют уголь или нержавеющую сталь, а в качестве катода — металл, ионы которого извлекают из раствора. Когда при электролизе толщина осаждаемого металла достигает 0,1—0,3 мм, процесс прекращают и металл снимают с электродов механическим или химическим способом. Модифицированный метод «Химэлектро», разработанный фирмой ВЕ №Т (Англия), позволяет извлекать металлы из промывных вод в электрохимическом аппарате с псевдоожиженным слоем из стеклянных шариков диаметром 0,5—2,0 мм (рис. 4.31).[ ...]
В оборотных системах водоснабжения промпредприятий используется метод электрокристаллизации солей жесткости на поверхности графитовых катодов при плотности тока 30—50 А/м2 с целью предотвращения накипеобразования и отложений в технологическом оборудовании. Для интенсификации процесса и кристаллизации солей в межэлектродном объеме размещается насадка из стекловолокна.[ ...]
Рисунки к данной главе:
| Схематические поляризационные кривые для совместного восстановления металла (1) и во-дорода (2) |
 |
| Извлечение металлов из сточных вод по методу «СЬете1ес» |
 |