Направление окислительно-восстановительных реакций, возможность их протекания и одновременного существования в растворах различных соединений позволяют определять значения стандартных потенциалов (табл. 3.1), составленных в порядке возрастания их положительных величин, т. е. отвечающих электрохимическому ряду металлов (так называемому ряду напряжений).[ ...]
Окисленная форма вещества с большим потенциалом является окислителем для восстановленных форм с более низким потенциалом, и, наоборот, восстановленная форма вещества является восстановителем для окисленных форм с более высоким потенциалом. Таким образом, пользуясь стандартным потенциалом, можно определить, в каком направлении пойдет реакция, и рассчитать ее окислительно-восстановительный потенциал, величина которого равна разности потенциалов окислителя и восстановителя.[ ...]
При этом ЕЬ — характеристика свободной энергии окислительно-восстановительной системы, а гН2— показатель окислительно-восстановительных свойств среды: чем меньше гН2, тем легче идут процессы восстановления; увеличение гН2 и, соответственно, уменьшение давления молекулярного водорода характеризует протекание окислительных процессов.[ ...]
Водные системы, в которых размещены электроды с потенциалом более отрицательным, чем потенциал водородного электрода, термодинамически неустойчивы. Реакции в таких системах должны протекать самопроизвольно в сторону получения более окисленных форм с одновременным разложением воды и выделением из нее газообразных продуктов электролиза.[ ...]
Системы, в которых применены электроды с потенциалами более положительными, чем у равновесного кислородного электрода ( + 0,401 В), также термодинамически неустойчивы и должны разлагать воду с выделением газообразного кислорода.[ ...]
Принципиальная возможность получения равновесного потенциала какой-либо электрохимической реакции определяется соотношением равновесного потенциала электрохимической реакции с участием молекул воды.[ ...]
Большое значение приобретают диаграммы применительно к системам металл — вода, возможность образования в которых комплексных ионов и гидроксидов, изменяющих свой состав в зависимости от pH, значительно усложняет взаимодействие с растворителем.[ ...]
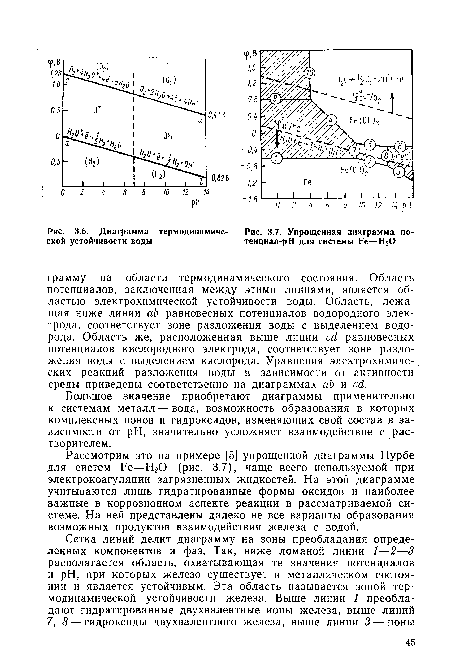
Рассмотрим это на примере [5] упрощенной диаграммы Пурбе для систем Ре—Н20 (рис. 3.7), чаще всего используемой при электрокоагуляции загрязненных жидкостей. На этой диаграмме учитываются лишь гидратированные формы оксидов и наиболее важные в коррозионном аспекте реакции в рассматриваемой системе. На ней представлены далеко не все варианты образования возможных продуктов взаимодействия железа с водой.[ ...]
Таким образом, диаграммы Пурбе позволяют оценить термодинамически вероятное поведение металлов в водных растворах, установить пределы потенциалов и pH, внутри которых данный металл должен быть устойчив, выяснить химическую природу продуктов коррозии и обосновать, за счет какой реакции (выделения водорода или восстановления кислорода) идет растворение металла.[ ...]
Рисунки к данной главе:
| Диаграмма термодинамической устойчивости воды |
 |