Нитропроизводные фенолов относят к биологически жестким соединениям. Так, в работе [66] указано, что присутствие в очищенной воде 2,4-динитрофенола в концентрации 5 мг/дм3 вызывает потерю активности ила на биологических очистных сооружениях уже через 2,5 ч. Увеличение числа нитрогрупп в молекуле органического вещества сопровождается обычно возрастанием его устойчивости по отношению к активному илу.[ ...]
В продуктах хлорирования нитрофенолов газохроматографическими исследованиями установлено наличие летучих хлорорганических соединений — хлорпикрина, хлороформа, фосгена, тетрахлорметана (СС14), ди-, три- и тетрахлорэтилена и ряда других веществ. При этом количество образующихся продуктов и их состав в основном определялся химическим строением хлорируемых веществ. Для 4-нитрофенола содержание летучих хлорорганических соединений минимально как по количеству, так и по составу (хлороформ, хлорпикрин). Максимальное количество хлорпикрина наблюдалось при хлорировании пикриновой кислоты. Присутствие алкильных заместителей в ароматическом кольце (ДНОК) способствовало появлению разнообразных соединений (рис. 17).[ ...]
Представляют интерес исследования, связанные с обработкой водных растворов нитрофенолов оксидом хлора (IV). Учитывая окислительный характер действия С102, можно было ожидать отсутствия в продуктах реакции хлорорганических соединений. Последнее позволило бы рекомендовать оксид хлора (IV) в качестве надежного реагента для обезвреживания нитрофенольных пестицидов.[ ...]
Окисление мононитрофенолов перманганатом калия в нейтральных водных растворах протекает с достаточно низкой скоростью и возрастает с понижением pH (табл. 17) [73]. Установлено, что продуктами реакции в условиях избыточных количеств нитрофенолов являлись замещенные хиноны. Отщепления нитрогруппы при окислении нитрофенолов перманганатом калия не наблюдалось [73].[ ...]
Поскольку окисление фенола пероксидом водорода протекает по свободно радикальному механизму, характер заместителей в ароматическом кольце, как видно из данных табл. 18, не оказывает влияния на скорость процесса. В нейтральной и щелочной среде при тех же условиях степень очистки Не превышает 10 % [74].[ ...]
Водные растворы нитрофенолов легко взаимодействуют с озоном. Установлено [75], что нитропроизводные фенола окисляются озоном значительно легче, чем нитропроизводные других классов органических соединений. Так, обработка воды, содержащей 4-нитрофенол и 2,4,6-тринитрофенол в концентрации 5-10 мг/дм3, дозами озона 3-5 мг/дм3 при времени контакта 3—5 мин приводила к полному их разрушению, стойкому исчезновению окраски и привкуса воды. Продолжительность процесса озонирования диктовалась исходной концентрацией нитросоединения. Для разрушения на 90—95 % высоких концентраций названных соединений (50—300 мг/дм3) оказалось достаточным озонирование в нейтральной среде в течение 30—50 мин, в щелочной — в течение 20—30 мин.[ ...]
Показано также, что продукты глубокого окисления нитрофенолов озоном практически нетоксичны и малокумулятивны, а следовательно, и менее опасны по сравнению с исходными соединениями.[ ...]
В работах [75—77] изучены особенности озонирования 2-нитро-и-крезола и 2-нитро-4-аминофенола. Показана возможность превращения в процессе озонирования нитрогруппы в нитрат-ион. Отмечается, что продукты деструкции биологически разрушаются значительно легче, чем исходные соединения. Скорость окисления названных соединений зависит от; pH среды.[ ...]
Исходные концентрации исследуемых веществ 100 мг/дм3. Концентрации солей железа 10 мг/дм3 .[ ...]
Рисунки к данной главе:
| Зависимость концентрации нитрофенолов от дозы введенного хлора при |
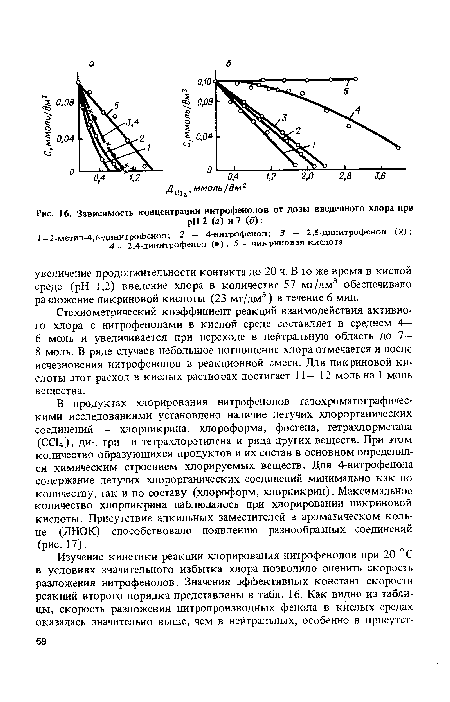 |
| Зависимость остаточной концентрации нитрофенолов от времени озонирования при pH 2 (а) и 7 (б) [скорость подачи озона 4,6 мг/ (мин • дм3) ] |
![Зависимость остаточной концентрации нитрофенолов от времени озонирования при pH 2 (а) и 7 (б) [скорость подачи озона 4,6 мг/ (мин • дм3) ]](/static/pngsmall/582625032.png) |
| Зависимость концентрации нитропроизводных фенола от содержания прореагировавшего озона и влияние дозы введенного озона на его расход |
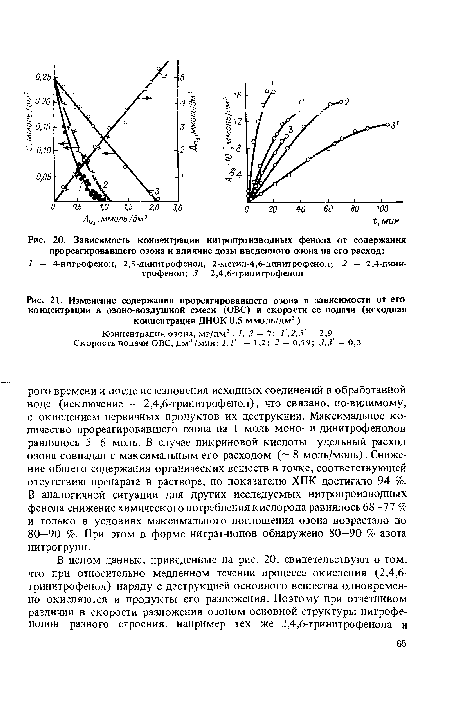 |
| Зависимость концентрации акрекса и содержания прореагировавшего озона от продолжительности озонирования (скорость подачи озона 3,2 мг/мин) pH |
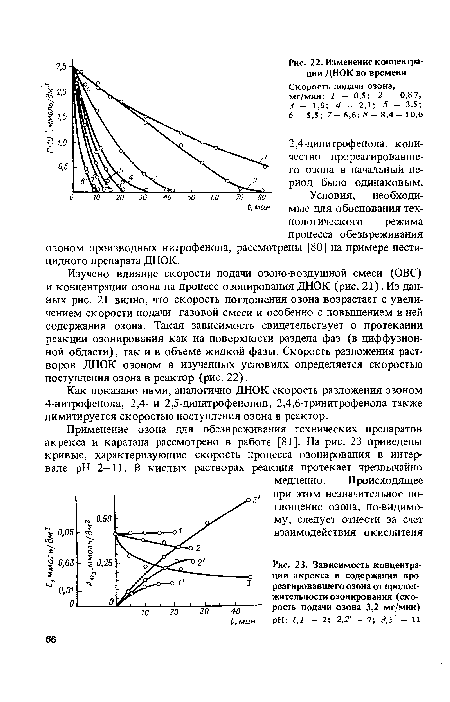 |