При жидкофазном окислении в нагретую до 180—300°С суспензию подается воздух под давлением, при котором вода испаряется не полностью. До начала процесса окислитель (кислород воздуха) в газообразном состоянии, а "горючее" (органические загрязнения) в жидком (раствор) или твердом (суспензия) состоянии. Как правило, органические загрязнения таких продуктов, как осадки сточных вод, легко окисляются. Плохо окисляются вещества, легко отгоняемые с водяным паром и нерастворимые в воде. Поэтому взаимодействие в процессе идет лишь в результате диффузии и растворения воздуха (кислорода) в воде.[ ...]
Систему определяют четыре основных параметра: температура, давление и концентрации воздуха в каждой из двух фаз растворителя. Такая система имеет две термодинамические степени свободы, т.е. только два параметра могут быть изменены без нарушения равновесия. Это означает также, что, например, при заданных температурю и концентрации воздуха в газовой фазе другие параметры (давление и концентрация воздуха в жидкой фазе) определяются расчетом. Температура задается из условия требуемой глубины химической реакции, а давление выбирается таким образом, чтобы количество растворенного кислорода было достаточным для окисления органических веществ до требуемой величины. Как правило, количественные величины параметров определяются экспериментально.[ ...]
Температура процесса является основным параметром при реакции окисления. Скорость реакции заметно возрастает уже при температуре 130°С, но с практической точки зрения нижним пределом является температура 150°С, при которой окисление начинает протекать весьма интенсивно. Ускорение реакции связано с возрастанием числа активных молекул, а следовательно, и числа эффективных соударений.[ ...]
Согласно теории "активных соударений" резкое увеличение скорости реакции зависит в основном не от числа столкновений, а от числа активных молекул, в которых возможна перегруппировка атомов.[ ...]
По расчетам ВНИИ ВОДГЕО, при повышении температуры на 10°С общее число столкновений увеличится приблизительно лишь на 2—3%, а число эффективных соударений — на 200—400% [26].[ ...]
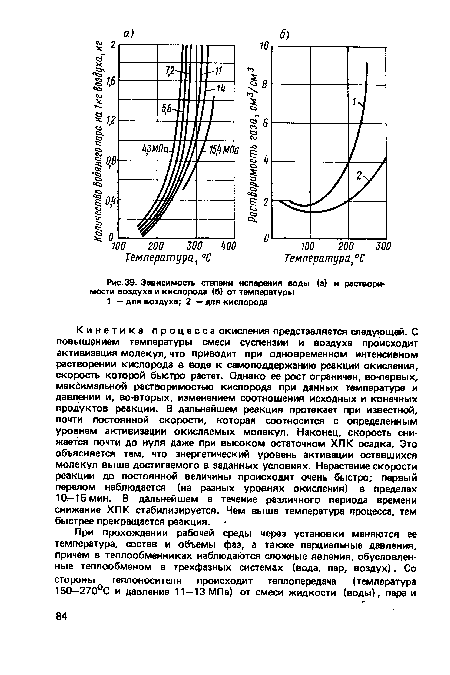
Растворимость воздуха в воде происходит интенсивнее с увеличением давления. При повышении температуры растворимость в воде смеси газов, близкой по составу к воздуху [11], примерно пропорциональна растворимости кислорода при любой температуре (рис. 39).[ ...]
Давление определяется температурой. В зависимости от давления меняются соотношения между количествами воды, находящейся в жидкой и газообразной фазах. Давление в системе - равно сумме парциальных давлений насыщенного пара и воздуха, причем с его увеличением (при определенной температуре) образуется меньше пара. Поскольку количество воздуха в системе определяется ХПК осадка и заранее известно, то при заданных температуре и давлении может быть вычислена степень испарения жидкой фазы. Телетцке приводит график зависимости количества пара, отнесенного к 1 кг сухого воздуха при насыщении, от температуры (см. рис. 39) [87].[ ...]
Кинетика процесса окисления представляется следующей. С повышением температуры смеси суспензии и воздуха происходит активизация молекул, что приводит при одновременном интенсивном растворении кислорода в воде к самоподдержанию реакции окисления, скорость которой быстро растет. Однако ее рост ограничен, во-первых, макбимальной растворимостью кислорода при данных температуре и давлении и, во-вторых, изменением соотношения исходных и конечных продуктов реакции. В дальнейшем реакция протекает при известной, почти постоянной скорости, которая соотносится с определенным уровнем активизации окисляемых молекул. Наконец, скорость снижается почти до нуля даже при высоком остаточном ХПК осадка. Это объясняется тем, что энергетический уровень активации оставшихся молекул выше достигаемого в заданных условиях. Нарастание скорости реакции до постоянной величины происходит очень быстро; первый перелом наблюдается (на разных уровнях окисления) в пределах 10-15 мин. В дальнейшем в течение различного периода времени снижение ХПК стабилизируется. Чем выше температура процесса, тем быстрее прекращается реакция.[ ...]
Ниже приведена схема расчета установки жидкофазного окисления.[ ...]
Рисунки к данной главе:
| Зависимость степени испарения воды (а) и растворимости воздуха и кислорода (б) от температуры 1 — для воздуха; 2 — для кислорода |
 |