Изотермы сорбции ОП-7 осадками гидратов окиси алюминия и железа, сульфида меди и фосфата кальция однотипны и имеют сложный вид (рис. III.1). Изотермы характеризуются тремя участками.[ ...]
Уравнение (Ш.1) может быть представлено прямой линией в координатах сТц — ¡йСраств (рис. 111.2). В логарифмических координатах деление изотерм на три участка сохраняется, удовлетворительное спрямление наблюдается только для первого и третьего участков. С помощью метода наименьших квадратов удалось установить, что спрямление указанным способом имеет наименьшую дисперсию, чем спрямление по другим типам изотерм (например, по изотерме Ленг-мюра). Второй участок занимает промежуточную область изученных концентраций.[ ...]
При формальном сходстве изотерм вида (Ш.1) с изотермой Фрейндлиха между ними имеются существенные различия в числовых значениях параметра ер. Так, наиболее вероятные значения 1/«р для изотермы Фрейндлиха равны 0,2—0,5, а на первых участках полученных изотерм ер намного меньше единицы (табл. Ш.1).[ ...]
На втором участке резкое уменьшение концентрации сорбированного вещества является следствием образования мицелл ОП-7 в объеме раствора. Мицеллообразование приводит к тому, что в точке ККМ происходит скачкообразное уменьшение концентрации частиц сорбата в растворе. В результате этого уменьшается и его содержание в твердой фазе.[ ...]
На третьем участке сорбция сорбата осадками происходит из мицеллярных растворов. Значения ф>1 можно объяснить, по-видимому, частичной диссоциацией мицелл при переходе ПАВ в поверхностный слой. Возможна и их своеобразная упаковка, при которой одна мицелла занимает несколько сорбционных центров.[ ...]
В результате происходит сдвиг ККМ в сторону столь высоких значений, которые не достигаются из-за пептизации осадка. Высокая щелочность раствора приводит к разрыву оксиэтиленовой цепи ПАВ и образованию низкомолекулярных продуктов гидролиза и, как следствие, к заметному увеличению ККМ. В свою очередь, однородность сорбата М2 (ОН) 2 приводит к монотонности изотермы, сводящейся к простейшей форме изотермы Генри. Приведенные в табл. III.1 значения ф наглядно подтверждают этот факт.[ ...]
К сожалению, проверить эквивалентность обмена не представляется возможным, так как неизвестно молекулярно-весовое распределение сульфокислот, входящих в состав КП, и, следовательно, неизвестен их средний молекулярный вес. Кроме того, в состав КП входят и ароматические сульфокислоты, поэтому расчет среднего молекулярного веса невозможен, если даже будет известно молекулярно-весовое распределение сульфокислот.[ ...]
На оксигидратных сорбентах также невозможно проверить правильность этого предположения, поскольку выделяющиеся в раствор в акте сорбции гидроксильные ионы нейтрализуются ионами водорода, получающимися при диссоциации сульфокислот; в результате эквивалентного обмена образуются молекулы воды и pH раствора практически не изменяется. Однако общий вид изотерм как для фосфата кальция, так и для гидроокисных осадков дает основание полагать, что в обоих случаях взаимодействие протекает по одной и той же схеме.[ ...]
Таким образом, неоднородность сорбента и сорбата не дает возможности количественно описать изотерму сорбции КП неорганическими сорбентами. И все же, исходя из самых общих представлений о характере взаимодействия сорбат — сорбент и некоторых очевидных допущений, можно понять последовательность процессов, происходящих в этих системах.[ ...]
Предположим, что первый участок изотермы, характеризующийся крутым подъемом и практически совпадающий с осью ординат, обусловлен взаимодействием молекул сорбата с группой изоэнергети-ческих центров сорбции. В результате большая часть молекул сорбата будет связана этими центрами (до полного насыщения сорбента по данной группе центров).[ ...]
Рисунки к данной главе:
| Ш.2. Изотермы сорбции ОП-7 различными сорбентами ([Ка1Ы03] =0,1 моль/л; тСОрб = 300 мг; ^ —18° С) |
![Ш.2. Изотермы сорбции ОП-7 различными сорбентами ([Ка1Ы03] =0,1 моль/л; тСОрб = 300 мг; ^ —18° С)](/static/pngsmall/555125000.png) |
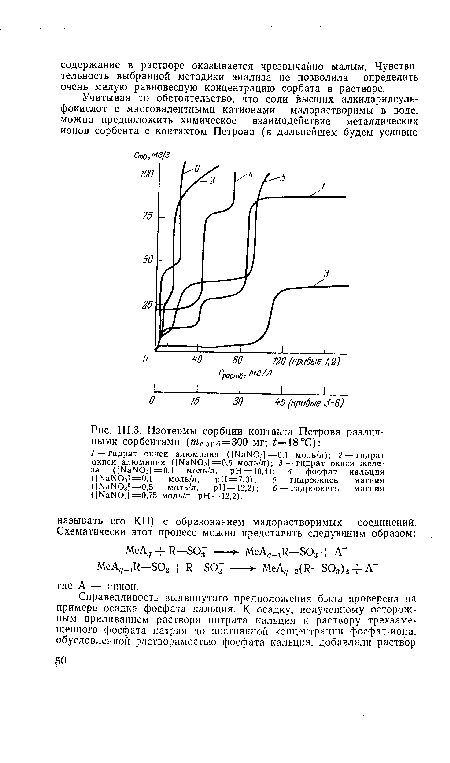
| Изотермы сорбции контакта Петрова различными сорбентами (/иСОрб=300 мг; ¿=18°С) |
 |
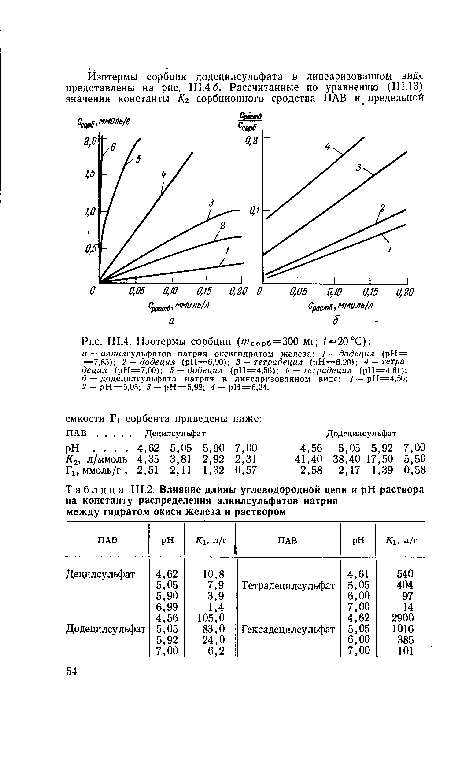
| Ш.4. Изотермы сорбции (тСОрб=300 мг; ¿=20°С) |
 |
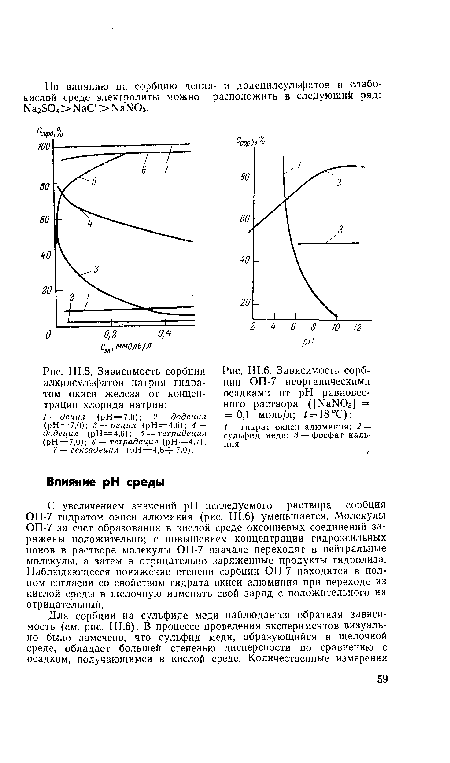
| Зависимость сорбции алкилсульфатов натрия гидратом окиси железа от концентрации хлорида натрия |
 |
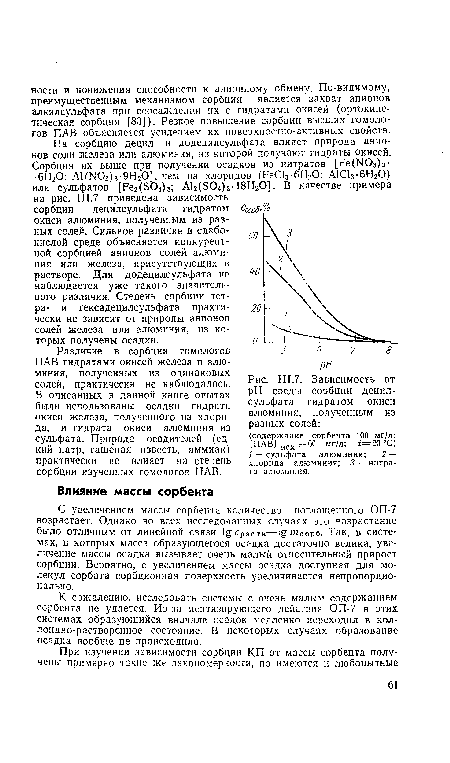
| Зависимость от pH среды сорбции децилсульфата гидратом окиси алюминия, полученным из разных солей |
 |