В случае если содержание прочих ионов (Ре2+, N0:7 и др.) превышает 0,1 ¡мг/л, то они также суммируются при вычислении Ей.[ ...]
Содержание Ре3+ и 51, формы содержания которых в воде неясны, при подсчете Ей не учитывается.[ ...]
Принцип метода. Прямое определение величины постоянной жесткости путем кипячения воды не дает сравнимых результатов, так как скорость выпадения карбонатов кальция и магния зависит от ряда причин, а именно от величины щелочности воды, продолжительности кипячения, интенсивности кипячения, условий отвода выделяющейся СОг, объема пробы, наличия катализатора и т. п. Кроме того, время, необходимое для полного выделения карбонатов кальция и магния, больше времени, в течение которого обычно ведут определение — кипятят воду (30—60 мин). Поэтому, как правило, реакция не доходит до конечного равновесия и прямое определение дает лишь условную величину, показывающую насколько полно для данной воды протекала реакция при данных условиях эксперимента.[ ...]
Учитывая условность величины, получаемой прямым определением, -более целесообразно применить расчет постоянной жесткости по ее значению при конечном установившемся равновесии, к которому в пределе стремятся экспериментально устанавливаемые величины. Для этого достаточно знать содержание главнейших ионов и соответствующие константы равновесия.[ ...]
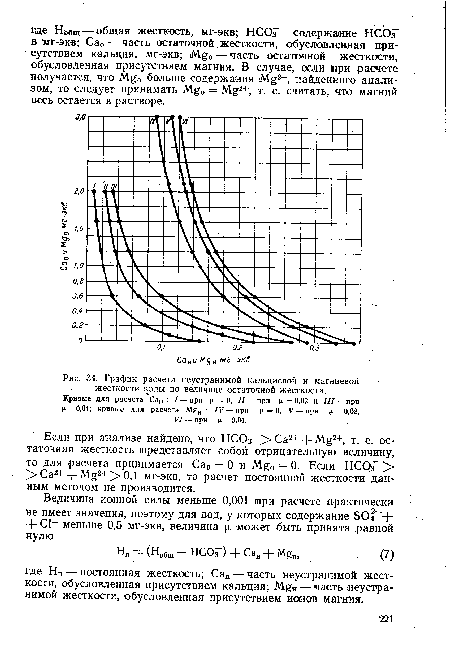
Остаточную жесткость (Нп), как видно, легко определить по результатам анализа воды. Сложнее установить слагающие ее после наступления равновесия величины Са0 и Mg0.[ ...]
Полученное ¡равенство преобразуем в уравнение Са2 - Са0Сап - + 1) = 0.[ ...]
Рисунки к данной главе:
| График расчета неустранимой кальциевой и магниевой жесткости воды по величине остаточной жесткости. |
 |