Золи являются гетерогенными системами. Из-за малого размера коллоидных частиц дисперсная фаза золя имеет колоссальную развитую общую поверхность, на которой проявляется поверхностная энергия. Наличие этой энергии у коллоидных частиц — одно из главнейших отличительных свойств коллоидной системы.[ ...]
При достаточном сближении молекул между ними возникают силы сцепления, получившие название ван-дер-ваальсовских (по имени голландского ученого Ван-дер-Ваальса). Силы сцепления проявляются в газообразных, жидких и твердых телах. Величина этих сил у твердых веществ больше, чем у жидкостей, слабее всего силы сцепления в газах.[ ...]
Следовательно, величина поверхностной энергии зависит от величины и формы поверхности, которая, в свою очередь, зависит от дисперсности частиц. Если вещество подвергать дроблению, то это ведет к увеличению его удельной поверхности (поверхность, отнесенная к единице объема вещества).[ ...]
Следовательно, при дроблении 1 см3 вещества- до коллоидного состояния общая поверхность его частиц возрастает с 6 см2 по крайней мере до 60 м2.[ ...]
Адсорбцией называется поглощение поверхностью вещества газов, паров и растворенных веществ за счет свободной поверхностной энергии.[ ...]
Вещество, способное адсорбировать на своей поверхности другое вещество, называется адсорбентом. А адсорбируемое вещество называется адсорбтивом.[ ...]
Адсорбент должен обладать свободным силовым полем, за счет которого поверхностный слой может притягивать к себе частицы из соприкасающейся с ним жидкой или газообразной фазы. Во многих случаях адсорбированный слой частиц является мономолекулярным, т. е. имеет толщину одной молекулы.[ ...]
Адсорбционное равновесие — это равновесие динамическое. Некоторые адсорбированные молекулы отрываются от адсорбента и переходят в окружающую среду. Это явление, обратное адсорбции, называется десорбцией. И наоборот, молекулы из окружающей среды могут осаждаться на адсорбент.[ ...]
Положение адсорбционного равновесия зависит как от концентрации поглощаемого вещества в соприкасающейся с адсорбентом среде, так и от температуры. Увеличение концентрации адсорбтива усиливает адсорбцию, а увеличение температуры вызывает десорбцию, так как процесс адсорбции является экзотермическим.[ ...]
Молекулы газообразного или парообразного вещества могут проникать (диффундировать) в толщу адсорбента, образуя с ним однородную массу. Процесс поглощения адсорбтива всей массой поглотителя называется абсорбцией. Следовательно, абсорбция — явление объемное, а адсорбция — чисто поверхностное. Примером абсорбции может служить процесс растворения любого газа в жидкости.[ ...]
Рисунки к данной главе:
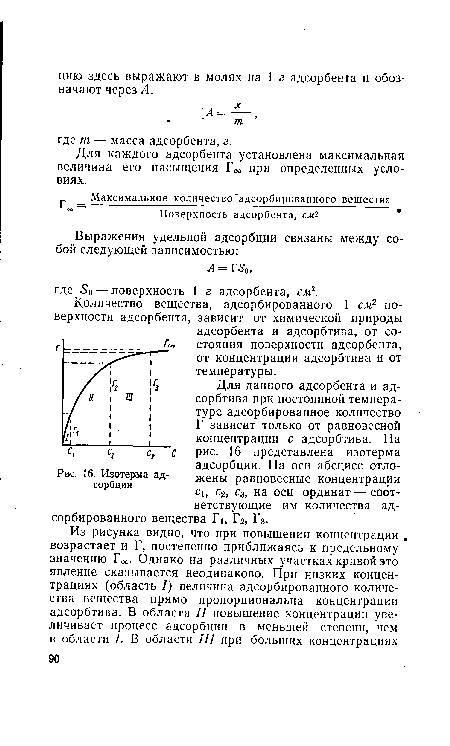
| Изотерма адсорбции |
 |
Аналогичные главы в дргуих документах:
| См. далее:Адсорбция |
| См. далее:Адсорбция |
| См. далее:Адсорбция |
| См. далее:Адсорбция |
| См. далее:Адсорбция |
| См. далее:Адсорбция |
| См. далее:Адсорбция |
| См. далее:Адсорбция |
| См. далее:Адсорбция |