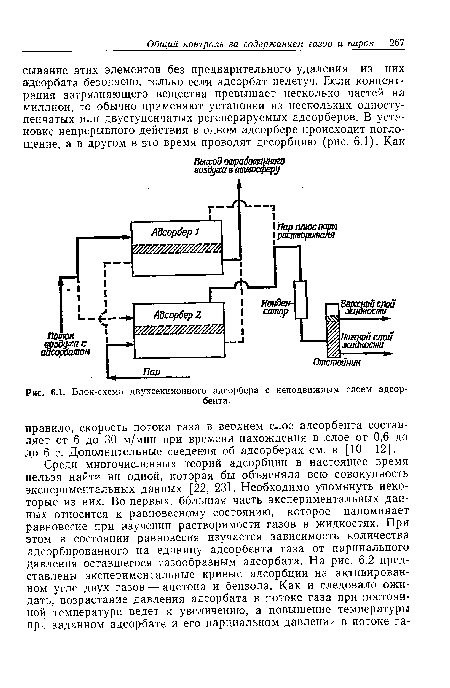
Такие важные загрязнители, как двуокись серы и окислы азота, будут описаны в отдельных главах. Несгоревшие углеводороды поступают в атмосферу при работе двигателей внутреннего сгорания, при сжигании топлива в стационарных установках и при других промышленных процессах, таких, как переработка нефти и сушка промышленных покрытий. Борьба с углеводородами и окисью углерода, выделяющимися при работе двигателей внутреннего сгорания, будет описана в гл. 10. Здесь же мы расскажем об основных принципах химической кинетики и дадим некоторую информацию о борьбе с окисью углерода и углеводородами, поступающими в атмосферу при работе стационарных источников. Начнем с описания двух широко применяющихся методов борьбы со многими газообразными загрязнителями в отходящих газах, а именно адсорбции и абсорбции.[ ...]
Адсорбцией называется процесс разделения, основанный на способности некоторых твердых веществ избирательно улавливать газообразные (или жидкие) компоненты из набегающего потока.[ ...]
Адсорбция дает экономическую возможность очистки газов, содержащих очень малые количества загрязнителя, что очень трудно, если вообще возхможно, с помощью других средств.[ ...]
Адсорбция подразделяется на физическую адсорбцию и хемосорбцию. При физической адсорбции молекулы газа прилипают к поверхности твердого адсорбента под действием межмолекуляр-ных сил притяжения (сил ван-дер-Ваальса). Адсорбция является экзотермическим процессом. Высвобождающаяся теплота, которая зависит от силы притяжения, по порядку величины совпадает с теплотой конденсации паров. Как правило, она находится в пределах от 2 до 20 кДж/моль. Преимуществом физической адсорбции является обратимость процесса. При уменьшении давления адсор-бата в потоке газа либо при увеличении температуры поглощенный газ легко десорбируется без изменения химического состава. Как правило, для этой цели используется температурный эффект. Обратимость данного процесса исключительно важна, если экономически выгодно рекуперировать адсорбируемый газ или адсорбент. Количество поглощаемого при химической адсорбции газа быстро уменьшается с повышением температуры и становится чрезвычайно малым, если температура превышает критическую температуру адсорбируемого вещества. Физическая адсорбция обычно прямо пропорциональна площади поверхности адсорбента. Однако на поверхности адсорбента может задерживаться не только мономоле-кулярный слой поглощаемого вещества; это может быть целый ряд слоев молекул. Другой существенной особенностью физической адсорбции является то, что скорость этого процесса обычно весьма велика.[ ...]
Упомянутый выше активированный уголь получается при обугливании угля, дерева, фруктовых косточек, скорлупы кокосовых орехов. Он активируется при обработке горячим воздухом или паром и выпускается в виде таблеток или гранул. Такой древесный уголь успешно применяется при рекуперации растворителей. Силикагель— гранулированный продукт, получаемый при воздействии серной кислоты на раствор силиката натрия. Он используется в первую очередь для обезвоживания воздуха и других газов, однако применяется при температурах не выше 250 °С. И активированный уголь, и силикагель могут подвергаться десорбции. Другим обезвоживающим реагентом является активированный глинозем, или окись алюминия. Он реактивируется нагреванием до температур от 175 до 325 °С. Фуллеровы земли — это природные глины, применяемые в нефтяной промышленности, так же как растительное й костяное масло. Адсорбированное органическое вещество удаляется промыванием или прокаливанием.[ ...]
Значительный интерес представляет использование искусственных цеолитов для удаления загрязняющих веществ из потока газа. Цеолиты широко применяются для уменьшения жесткости воды. Используемые в настоящее время искусственные цеолиты представляют собой металлсодержащие кристаллические алюмосиликаты, получившие название молекулярных сит [21]. Их большим преимуществом является селективность, которая достигается правильным выбором кристаллической структуры, в результате чего они способны адсорбировать только определенные виды молекул. Поры каждого типа молекулярных сит однородны по своим размерам, и в зависимости от этих размеров молекулы газа могут адсорбироваться быстро или медленно либо вообще не адсорбироваться. Кроме разделения молекул по размерам молекулярные сита могут также разделять молекулы с различным дипольным моментом и углеводороды с разной степенью ненасыщенности. Молекулярные сита могут восстанавливать свои свойства при нагревании или элюции (экстракции селективными растворителями).[ ...]
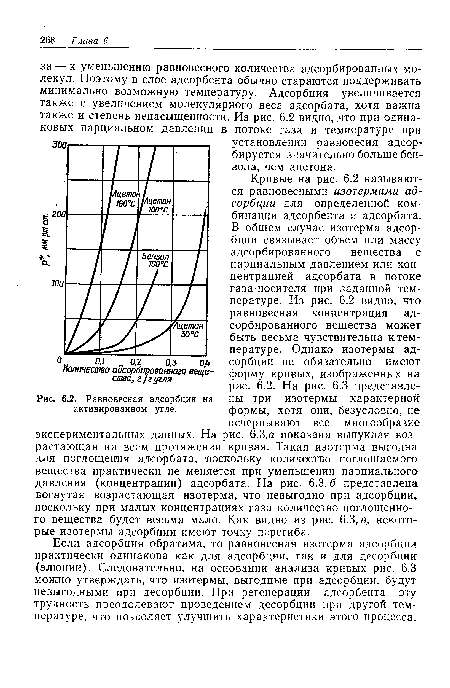
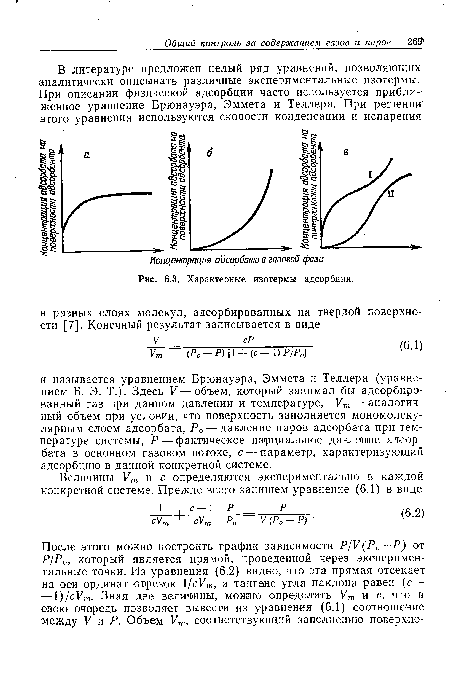
Если адсорбция обратима, то равновесная изотерма адсорбции практически одинакова как для адсорбции, так и для десорбции (элюции). Следовательно, на основании анализа кривых рис. 6.3 можно утверждать, что изотермы, выгодные при адсорбции, будут невыгодными при десорбции. При регенерации адсорбента эту трудность преодолевают проведением десорбции при другой температуре, что позволяет улучшить характеристики этого процесса.[ ...]
С — концентрация адсорбата в частях на миллион, М — молекулярный вес адсорбата.[ ...]
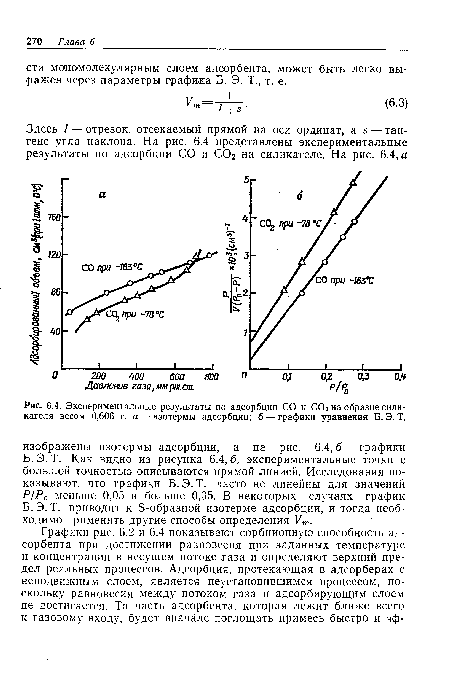
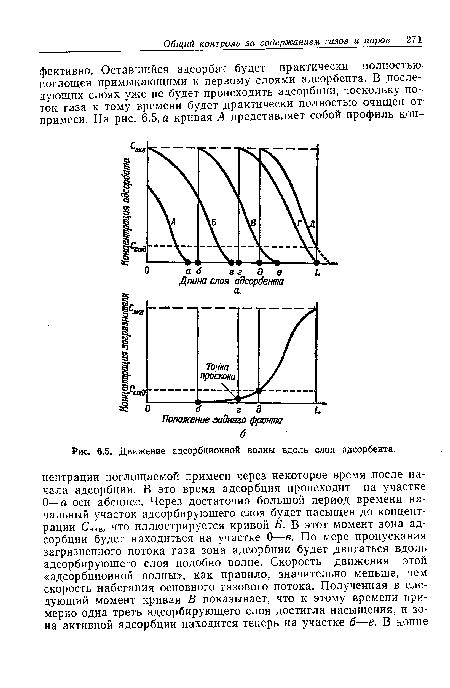
Эта формула может быть использована для оценки времени работы адсорбера с неподвижным слоем адсорбента, если недостаточно экспериментальных данных, полученных при ожидаемых в работе условиях. Предсказание момента проскока является ключевым вопросом при конструировании адсорберов с неподвижным слоем. Показано, что тип достигаемого равновесия (см. кривые на рис. 6.3) является определяющим критерием при оценке момента проскока. Методы определения рабочих характеристик адсорберов с неподвижным слоем адсорбента описаны в литературе [9].[ ...]
Рисунки к данной главе:
Аналогичные главы в дргуих документах:
Вернуться к оглавлению