В случае разбавленных растворов приближенно можно считать, что рх = —1§[х], следовательно, рКл = pH + рОН = 14.[ ...]
Чтобы контролировать реакцию нейтрализации, надо знать, какое количество кислоты или щелочи следует добавить в раствор для получения необходимого значения pH. Для решений этой проблемы может быть использован метод эмпирической оценки стехиометрических коэффициентов, которая осуществляется с помощью титрования.[ ...]
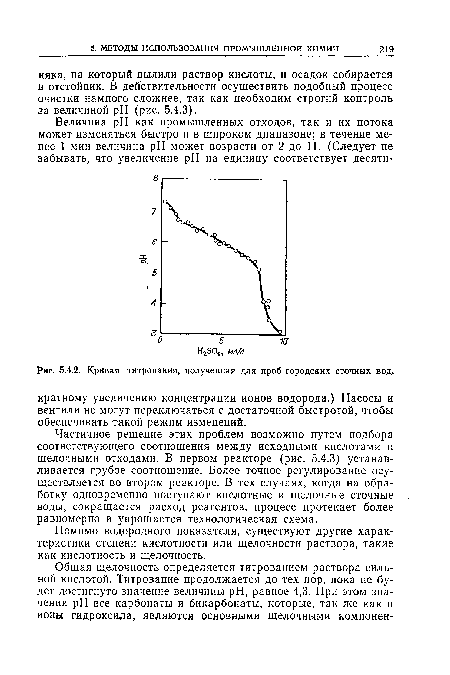
Титрование — это основной метод объемного химического анализа, заключающийся в постепенном добавлении титрованного раствора к раствору вещества, количество которого необходимо определить. По объему израсходованного титрованного раствора вычисляется количество данного вещества. Изменение величины pH в зависимости от количества добавленной кислоты (щелочи) можно изобразить графически в виде кривой титрования. Располагая образцами сточной воды, можно построить кривую титрования (рис. 5.4.2). Однако довольно часто мы анализируем системы, существующие только на бумаге, и в этих случаях вынуждены производить громоздкие расчеты.[ ...]
Природа соли зависит от смешивающихся кислот и щелочей. Так, все соли натрия растворимы, соли кальция при высоких концентрациях могут быть нерастворимыми. Например, известь Са(ОН)2 образует осадок с серной, фтористоводородной и фосфорной кислотами. Выбор химически нейтрализующего агента зависит от его стоимости, в которую входит и стоимость удаления осадка.[ ...]
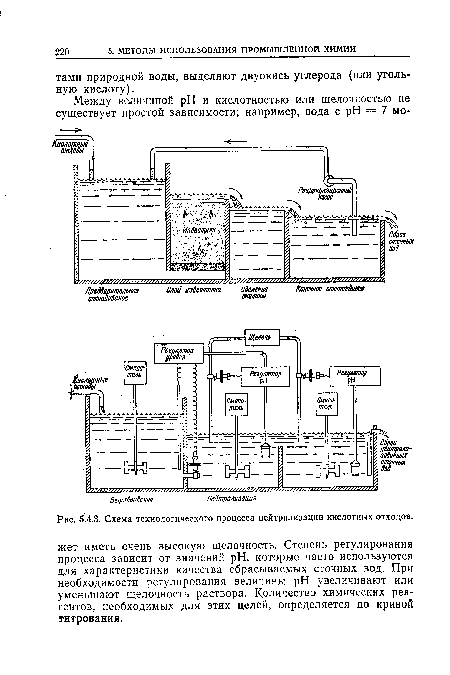
Частичное решение этих проблем возможно путем подбора соответствующего соотношения между исходными кислотами и щелочными отходами. В первом реакторе (рис. 5.4.3) устанавливается грубое соотношение. Более точное регулирование осуществляется во втором реакторе. В тех случаях, когда на обработку одновременно поступают кислотные и щелочные сточные воды, сокращается расход реагентов, процесс протекает более равномерно и упрощается технологическая схема.[ ...]
Помимо водородного показателя, существуют другие характеристики степени кислотности или щелочности раствора, такие как кислотность и щелочность.[ ...]
Для удаления железа из воды используется его способность образовывать нерастворимую в воде соль — гидроокись железа Ре(ОН)3, константа растворимости которой равна 1,0-10 38. Определим количество железа, остающегося в растворе при pH = 5 и 10.[ ...]
При pH = 5 величина рОН = 14—5 = 9, и, следовательно, [ОН-] = ю-9.[ ...]
Рисунки к данной главе:
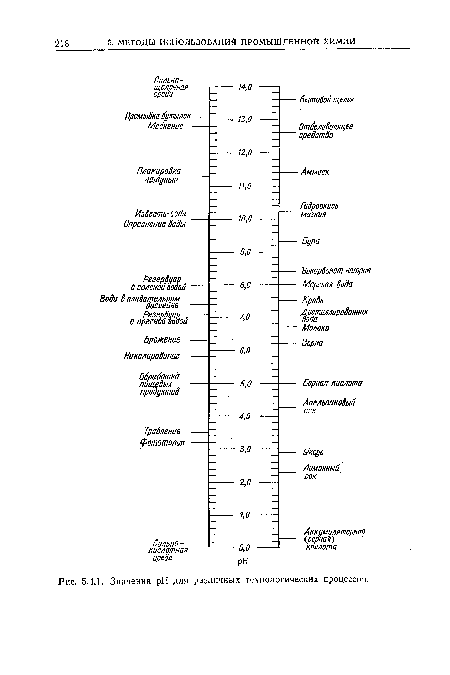
| Значения pH для различных технологических процессов. |
 |
| Кривая титрования, полученная для проб городских сточных вод. |
 |
| Схема технологического процесса нейтрализации кислотных отходов. |
 |