Следовательно, только переходы между электронными уровнями могут обусловить возникновение цвета — окраски. Поглощение фотонов, переводящих молекулу с основных и колебательных уровней на соответствующие возбужденные, не связано с возникновением зрительных ощущении. Однако каждое изменение энергии электронов сопровождается изменениями вращательной и колебательной энергии, так как молекула одновременно поглощает фотоны, соответствующие различным частям электромагнитного спектра, и электронные переходы (электронное возбуждение) происходят одновременно с вращательными и колебательными переходами. Поэтому спектры поглощения состоят из большого числа линий поглощения, которые перекрываются и образуют полосы. В этом смысле поглощение фотонов, вызывающих вращательные и особенно колебательные энергетические переходы, оказывает влияние на цвет вещества, поскольку оттенки окраски зависят от ширины и характера полосы поглощения.[ ...]
Различия в энергии возбуждения электронов, входящих в состав молекул, обусловлены следующим: а) принадлежностью к наружным или внутренним электронным оболочкам (слоям) атомов; б) участием или неучастием в образовании связей между атомами; в) характером связей и их взаимным расположением.[ ...]
Валентные электроны, не участвующие в образовании связей с другими атомами, — не-поделенные пары электронов, локализованные в поле одного ядра, — имеют энергию того же порядка, что и валентные электроны в атоме; они занимают так называемые несвязывающие орбитали п.[ ...]
При возникновении простой связи между атомами (а-связи) два электрона (о-электроны), которые по своей природе относятся к числу s-электронов, /7-электронов и гибридных sp3- и х/>2-электронов, переходят в поле двух соседних ядер и образуют единое вытянутое электронное облако, симметричное относительно прямой, соединяющей центры атомов, причем максимальная плотность облака о-электронов сосредоточена в промежутке между этими атомами.[ ...]
Переход электронов с несвязывающих я-орбиталей на связывающую о-орбиталь сопровождается выигрышем энергии, вследствие чего уровень энергии связывающих о-орбиталей значительно ниже уровня энергии я-орбиталей.[ ...]
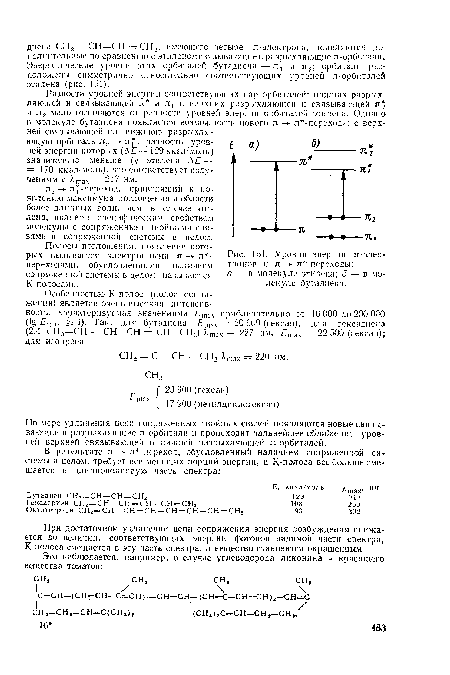
Переход электронов с несвязывающих я-орбиталей на связывающую я-орби-таль сопровождается выигрышем энергии, меньшим, однако, чем при образовании o-связи. Поэтому уровень энергии связывающих я-орбиталей располагается между уровнями энергии я-орбиталей и связывающих о-орбиталей.[ ...]
В соответствии с принципом Паули на каждой орбитали размещается по два1 электрона с антипараллельными спинами. Обычно в основном состоянии все связывающие и несвязывающие орбитали заняты, и переход в возбужденное состояние означает переход соответствующих электронов на свободные орбитали с более высокими уровнями энергии—на так называемые разрыхляющие (антисвязывающие) орбитали (о -> о , я ->• я , я -> о и я -у л переходы, см. рис. 178). По уровню энергии эти орбитали расположены выше несвязывающих ft-орбиталей, причем каждой связывающей о- и я-орбитали соответствует разрыхляющая о - и я -орбиталь. В большинстве случаев по уровню энергии орбитали располагаются в ряд о<я<я<я < о .[ ...]
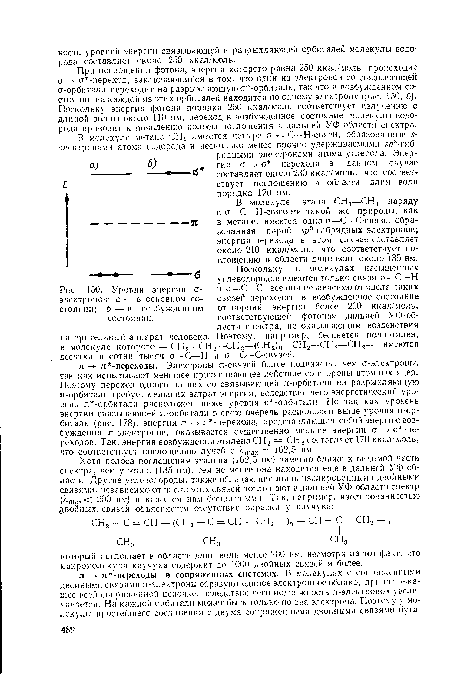
При поглощении фотона, энергия которого равна 250 ккал/моль, происходит о о -переход, заключающийся в том, что один из электронов со связывающей а-орбнтали переходит на разрыхляющую о -орбиталь, так что в возбужденном состоянии на каждой из этих орбиталей находится по одному электрону (рис. 150, б). Поскольку энергия фотона порядка 250 ккал/моль соответствует излучению с длиной волны около 110 нм, переход в возбужденное состояние молекулы водорода приводит к появлению полосы поглощения в дальней УФ-области спектра.[ ...]
Рисунки к данной главе:
| Энергетические уровни и типы электронных переходов. |
 |
| Уровни энергии о-электронов |
 |
| Уровни энергии л-элек-тронов и л - л -переходы |
 |