После эквивалентной точки ионы железа (II) отсутствуют в растворе, а введенный избыток бихромата калия создает окислительно-восстановительную систему хрома Е 02- с з+ • Соответственно этому платиновый электрод после эквивалентной точки принимает потенциал окислительно-восстановительной системы хрома. Переход потенциала платинового индикаторного электрода от одной окислительно-восстановительной системы к другой сопровождается скачком потенциала в точке эквивалентности, что указывает на конец титрования.[ ...]
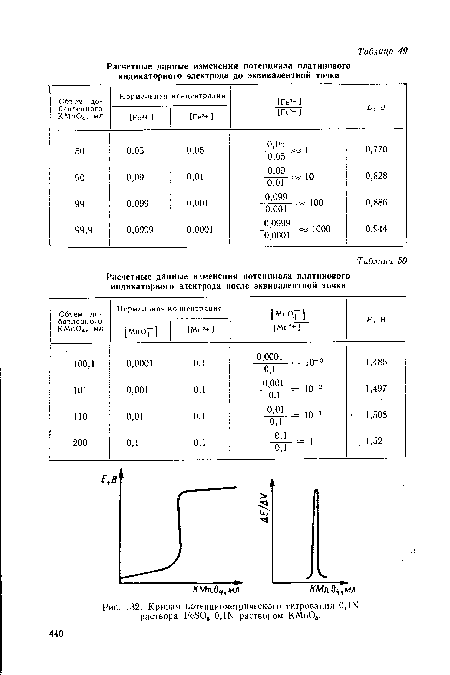
Кривые потенциометрического титрования в окислительно-восстановитель-ных реакциях. Потенциал платинового индикаторного электрода зависит от соотношения концентраций окисленной и восстановленной форм. Проследим изменение потенциала электрода при титровании соли железа перманганатом калия в кислой среде.[ ...]
Можно пользоваться любым из этих уравнений, дающими одинаковые результаты. Однако для определения потенциала электрода до т. э., когда еще не все железо оттитровано, лучше использовать уравнение (48), а после т. э., когда к раствору добавлен избыток перманганата калия, — уравнение (49).[ ...]
Зависимость (50) — суммарное уравнение равновесия. В точке эквивалентности ионы МпО вводят в раствор в количестве, соответствующем вышеприведенному суммарному ионному уравнению. Тогда при равновесии на каждый оставшийся ион приходится пять ионов Ре2+, т. е.[ ...]
Кривые потенциометрического титрования 0,1Ы раствора Ре304 0,Ш раствором КМп04 имеют вид (рис. 132).[ ...]
Рисунки к данной главе:
| Кривая потенциометрического титрования 0,Ш раствора РеБ04 ОДЫ раствором КМп04. |
 |