В связи с тем что методы осаждения и комплексообразования играют важную роль в санитарно-химическом анализе, мы сочли необходимым ознакомить читателя с двумя типами электродов: серебряными и ртутными, образующими в растворе солей серебра и ртути системы Н§/Нйз+; Ag/Ag+. С помощью последних можно потенциометрически определить концентрацию ионов серебра и ртути, а также концентрации тех ионов, которые с серебряными и ртутными ионами образуют труднорастворимые соли и комплексы.[ ...]
Значения последних зависят от концентрации катиона и аниона труднорастворимой соли в растворе, и поэтому эти электроды используются для определения концентраций ионов металлов анионов: Cl“; Вг ; I-; S2".[ ...]
В последние годы нашли применение ионообменные мембраны, функционирующие как обратимые электроды к любому иону, например к ионам Н+, NOJ , СН3СОСГ, Li + , Mg2-, Ва2 и др., и позволяющие использовать их в потенциометрическом титровании в качестве индикаторных электродов. Эти мембраны в будущем должны найти широкое применение в санитарно-химическом анализе.[ ...]
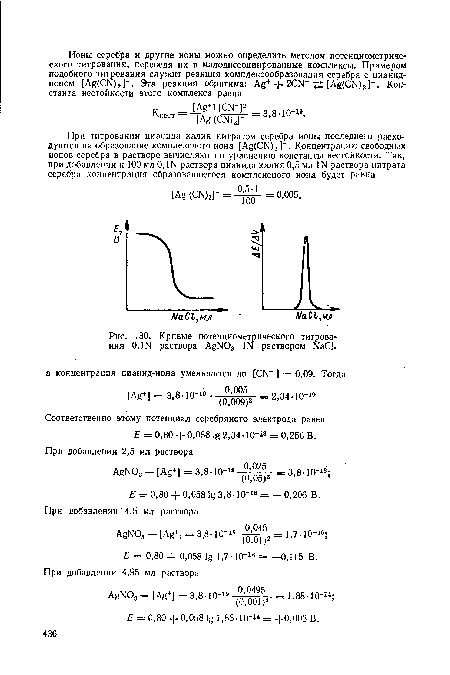
Полученные по ходу титрования расчетные данные изменения потенциала серебряного электрода сводят в табл. 48 изменений потенциала серебряного электрода при титровании 100 мл 0,Ш раствора AgN03 Ш раствором К аС1. При этом пренебрегают изменением объема.[ ...]
Ниже приведены кривые потенциометрического титрования нитрита серебра раствором хлорида (рис. 130). В точке эквивалентности наблюдается резкий скачок потенциала, величина которого зависит от растворимости образующегося осадка. Чем меньше растворимость осадка и его ПР, тем больше скачок потенциала в точке эквивалентности.[ ...]
Соответственно этому потенциал серебряного электрода равен Е = 0,80 + 0,058 2,34-10-1» = 0,256 В.[ ...]
За точкой эквивалентности наблюдается образование малорастворимого осадка А§2(СК)2, растворимостью которого определяется концентрация ионов серебра и, следовательно, значение электродного потенциала. Потенциал индикаторного электрода остается постоянным до тех пор, превратится в осадок. Кривая потенциометрического титрования по описываемому методу, изображенная на рис. 131, показывает характерный скачок потенциала в т. э. и горизонтальный участок после окончания процесса комплексообразован ия.[ ...]
Рисунки к данной главе:
| Кривые потенциометрического титрования 0,Ш раствора AgNOз Ш раствором КаС1. |
 |