Обсудив природу молекулы воды в идеальном паре, где молекулы не взаимодействуют друг с другом, рассмотрим реальный пар. Свойства реального пара, подобно свойствам льда и жидкой воды, определяются силами, действующими между молекулами. Действительно, исследования воды в парообразном состоянии внесли важный вклад в наши знания о взаимодействиях молекул воды. В этой главе мы рассмотрим сначала происхождение этих сил и их связь со вторым и третьим вириаль-ными коэффициентами пара. Затем подробно обсудим термодинамические свойства реального пара. Мы не будем рассматривать другие свойства пара, такие, как его вязкость и теплопроводность, поскольку эти свойства не являются достаточно полезными для понимания льда, жидкой воды или природы сил, действующих между молекулами воды.[ ...]
Функция и имеет отрицательный знак, если суммарная сила является силой притяжения. Моменты вращения, появляющиеся у молекул при взаимном влиянии их друг на друга, выражаются через частные производные от и по углам.[ ...]
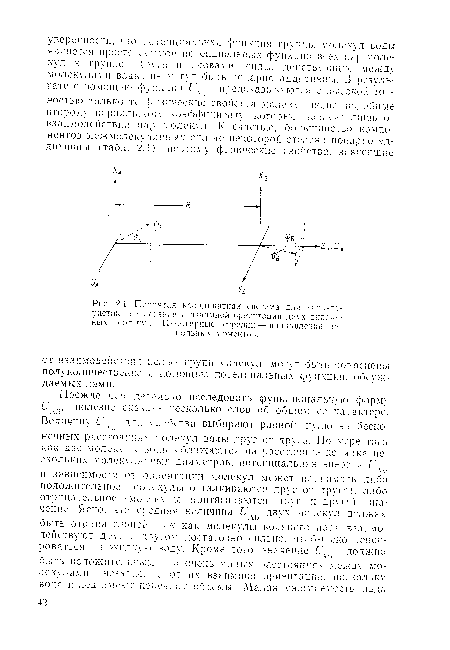
Все атомы находятся в плоскости рисунка за исключением атома Н в конфигурации е.[ ...]
Очевидно, статистическое среднее значение Um вращающихся молекул уменьшается значительно быстрее с изменением расстояния, чем сами величины U . По данным табл. 2.2 видно, что при межмолекулярном расстоянии 10 А величина (t/ ) составляет только 3% максимального значения Um.[ ...]
По данным табл. 2.2 видно, что на расстояниях 5 А и более индукционные силы составляют только небольшую часть суммарной дальподействующей силы. Это утверждение не относится к случаю льда и жидкой воды, где молекулы расположены ближе друг к другу и индукционные силы, действующие между молекулами воды, имеют относительно более важное значение. В этих фазах близость молекул воды друг к другу и коррелирование их ориентаций приводят к очень большим наведенным диполь-ным моментам, которые в свою очередь вносят значительный вклад в межмолекулярные силы (см. п. 3.4.1).[ ...]
Комбинируя уравнения (2.8) и (2.9) и подставляя в них величины а и (г2) (см. табл. 1.5 и п. 1.1.3), найдем, что уравнение Кирквуда—Мюллера дает значение коэффициента с в уравнении (2.7), равное 84,9- 10 60 эрг • см6. Мы воспользовались этим значением коэффициента с для вычисления величин б дисп (табл. 2.2).[ ...]
В заключение следует сказать несколько слов об образовании водородных связей. Несмотря на то что имеются убедительные доказательства существования водородных связей во льду и жидкой воде, мы не располагаем прямыми данными о наличии водородной связи между двумя молекулами воды в парообразном состоянии. Действительно, спектроскопические исследования показывают, что водородные связи редко имеют место в водяном паре или вообще не существуют в нем. Этот вывод основан на наблюдении, что образование водородной связи между молекулой, содержащей гидроксильную группу (X—О—Н) и другой атом, обычно сопровождается заметным уменьшением валентной частоты О—Н и незначительным увеличением деформационной частоты X—О—Н [280] (см. пункты 3.5.1 и 4.7.1). Сходные, но меньшие по величине сдвиги частоты наблюдались в процессе образования димеров и других малых полимеров из молекул воды. Авторы работы [356] наблюдали такие сдвиги при изучении инфракрасного спектра молекул воды, находящихся в матрице из атомов азота при 20 К. При этом наблюдаемые полосы поглощения 3546 и 3691 см-1 были отнесены к валентным модам димеров (Н20)2. Эти частоты значительно ниже, чем валентные моды V] и Уз изолированных молекул Н О (3657 и 3756 см-1 соответственно). Эти авторы отнесли наблюдаемую полосу поглощения при 1620 см“1 к деформационной моде димера.[ ...]
Согласно вышеизложенному, можно было бы ожидать, что спектроскопические методы позволяют обнаружить наличие сколько-нибудь заметного числа молекул, соединенных водородными связями в водяном паре. Поэтому интересно, что тщательное сравнение инфракрасных спектров разбавленного и концентрированного водяного пара в области моды х2 не показывает различий в частотах поглощения. Так, например, Бенедикт и другие [17] сравнили солнечный спектр атмосферы (разбавленный водяной пар при средней температуре 14° С) со спектром почти насыщенного пара (давление 1 атм, температура 110° С) в области моды ч В обоих случаях они измерили частоты спектральных линий и их интенсивности в области от 770 до 2200 см“1. Найденные ими различия относились к незначительным изменениям интенсивности, приписываемым изменению температуры. Был сделан вывод, что, если димеры, имеющие квантованные вращательные состояния, присутствуют в насыщенном водяном паре при давлении 1 атм, их концентрация относительно мономеров должна быть менее 1%.[ ...]
Следует отметить, что выражение «водородная связь» использовалось выше для обозначения специфической ассоциации атома водорода одной молекулы с неподеленной парой электронов другой молекулы, как это имеет место во льду. Второй вириальный коэффициент пара (п. 2.1.3) не оставляет сомнения в том, что димеры присутствуют в водяном паре. Однако нет данных, подтверждающих, что эти димеры содержат водородные связи типа найденных во льду. Действительно, температурная зависимость второго вириального коэффициента может быть объяснена с помощью потенциальных функций, содержащих только члены, подобные рассмотренным выше. При этом любая потенциальная функция скорее будет связана с взаимной ориентацией двух молекул воды типа голова-к-хвосту (см. рис. 2.3 а), а не с взаимными ориентациями молекул, существующими во льду (см. рис. 2.3 е). Водородные связи между молекулами воды могут быть стабильными только в кластерах, где среднее число водородных связей больше, чем в димере. Из-за недостатка информации о водородных связях между молекулами в водяном паре отложим изучение потенциальных функций молекул воды, соединенных водородными связями, до главы, в которой рассматривается лед.[ ...]
Рисунки к данной главе:
| Принятая координатная система для характеристик |
 |
| Потенциальная энергия взаимодействия двух молекул воды, имеющих фиксированные взаимные ориентации в соответствии с потенциалом Штокмайера [уравнение (2.17)]. |
![Потенциальная энергия взаимодействия двух молекул воды, имеющих фиксированные взаимные ориентации в соответствии с потенциалом Штокмайера [уравнение (2.17)].](/static/pngsmall/318624992.png) |
| Взаимные ориентации двух молекул воды, энергии взаимодействия которых даны в табл. 2.2. |
 |