Многие вещества, обусловливающие мутность воды, не выпадают из раствора (например красители, частички глины, микроскопические организмы и органические вещества, образующиеся при гниении растений или содержащиеся в бытовых сточных водах).[ ...]
Размеры этих частиц, называемых коллоидами, колеблются от 1 до 500 ¡нм; ¡¡при наблюдении под обычным микроскопом они невидимы. Дисперсная система, образованная коллоидными частицами, устойчива в воде, находящейся в покое, так как отдельные частицы имеют настолько большую поверхность относительно их веса, что силы тяжести не влияют на состояние такой системы. Коллоиды классифицируются на гидрофобные («не любящие воду») и гидрофильные («любящие воду»).[ ...]
Гидрофильные коллоиды стабильны скорее вследствие их притяжения к молекулам воды, чем вследствие небольшого электрического заряда, который они имеют. Типичными примерами гидрофильных коллоидов могут служить мыло, растворимый крахмал, синтетические детергенты и сыворотка крови. Из-за большого сродства к воде гидрофильные коллоиды не так легко удалить из раствора, как гидрофобные; именно поэтому для коагуляции гидрофильных коллоидов требуются дозы коагулянтов, в 10—20 раз большие, чем при традиционной технологии обработки воды.[ ...]
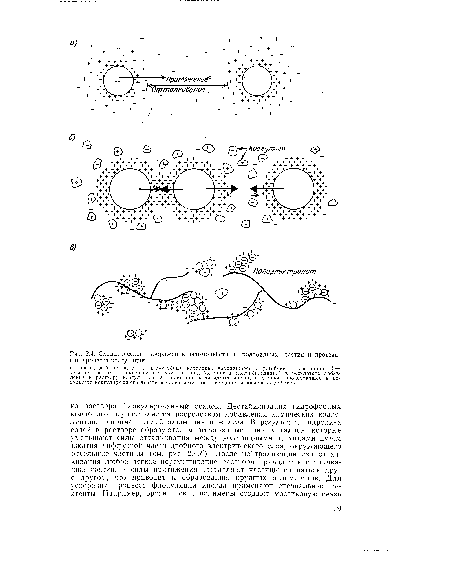
Устойчивость суспензии гидрофобных частиц, не обладающих сродством к воде, зависит от их электрического заряда. К этому типу веществ принадлежит большая часть органических и неорганических веществ, создающих мутность природной воды. Силы, действующие на гидрофобные коллоиды, показаны на рис. 2.4,а. Отдельные частицы удерживаются на расстоянии друг от друга вследствие электростатических сил отталкивания, вызываемых положительно заряженными ионами, которые адсорбируются из раствора на поверхностях этих частиц. Силы отталкивания аналогичны силам, возникающим между одноименными полюсами двух электромагнитов. Величина сил отталкивания, развиваемых заряженным двойным слоем ионов на поверхности частиц, называется электрокинетическим потенциалом (дзета-потенциалом) .[ ...]
Между любыми двумя частицами веществ возникают силы взаимодействия (силы Ван-дер-Ваальса), притягивающие частицы друг к другу. Беспорядочное движение коллоидов (броуновское движение), вызываемое бомбардировкой последних молекулами воды, обусловливает тенденцию к увеличению сил притяжения ¡между частицами. Однако в тех случаях, когда силы отталкивания превосходят силы притяжения, коллоидная система остается в дисперсном состоянии.[ ...]
Эффективность устранения мутности воды путем коагуляции зависит от типа коллоидных частиц, температуры, значения pH, химического состава воды, от вида и доз коагулянтов и вспомогательных веществ, а также от продолжительности и степени перемешивания. Хотя в химии термин «коагуляция» означает дестабилизацию коллоид- : ной дисперсной системы путем нейтрализации двойного электрического слоя (см. рис. 2.4,а), а «флокуляция» означает слипание частиц, специалисты употребляют эти термины не только для обозначения химических явлений. Чаще всего коагуляцию и флокуляцию связывают с физическими процессами, протекающими при химической обработке воды. Для растворения коагулянтов и смешивания их с обрабатываемой водой применяют перемешивание, иногда весьма энергичное. Флокуляция, протекающая непосредственно за процессом химиче- 1 ской дестабилизации дисперсной системы, представляет собой медленный процесс соединения дестабилизированных частиц в хорошо сформированные хлопья, размер которых достаточен для выпадения их из раствора. Слово «коагуляция» обычно употребляют для описания всего процесса смешивания и флокуляции. Технологически химическая обработка может быть представлена серией сооружений для смешивания, флокуляции и осаждения или совмещена в одном устройстве. Подобное комплексное устройство (см. рис. 7.8) обычно обеспечивает быстрое перемешивание (в течение 1 мин), флокуляцию (35 мин) и седиментацию (4 ч), после чего воду фильтруют через песчаные фильтры для удаления неосаждающихся частиц. В центральной смесительной камере флокулятора-осветлителя (см. рис. 7.9) обрабатываемая вода смешивается с введенными в нее реагентами и уже флокулированными частицами. Твердые частицы, осевшие на периферии, автоматически возвращаются в зону смешения; избыток осадка удаляется со дна камеры.[ ...]
Рисунки к данной главе:
| Схематическое изображение взаимодействия коллоидных частиц и протекания процесса коагуляции |
 |