Загрязнения, попадающие в атмосферу, могут претерпевать ряд химических превращений, приводящих к образованию нежелательных продуктов, являющихся, в частности, причиной фотохимического смога. Для атмосферных реакций, обычно происходящих при довольно низких температурах, важным фактором активации молекул является солнечный свет. «Бимолекулярное» взаимодействие кванта света с молекулой и вызываемые им последующие физические и химические изменения называются фотохимической реакцией.[ ...]
Электронно-возбужденные молекулы могут вступать в такие реакции, которые невозможны или сильно затруднены в невозбужденном состоянии. Объясняется это тем, что избыток энергии облегчает преодоление активационных барьеров, кроме того молекула в возбужденном состоянии часто имеет совсем иное распределение электронной плотности, чем в обычном состоянии, и поэтому могут осуществляться «необычные» превращения.[ ...]
Молекула в возбужденном состоянии весьма нестабильна, поэтому вторая реакция протекает быстро. Один или оба продукта В и С, будучи очень реакционноспособными, могут дать начало цепи реакций с образованием нежелательных продуктов и явиться причиной появления фотохимического смога.[ ...]
Поэтому число молекул, подвергающихся химической реакции при поглощении кванта света, обычно отличается от единицы, хотя, согласно закону Эйнштейна, каждый квант поглощенного света в области сплошного спектра вызывает элементарную химическую реакцию.[ ...]
Но квантовый выход может быть как меньше единицы, так и значительно превосходить ее, достигая многих сотен. Образовавшиеся при фотодиссоциации радикалы могут положить начало цепным радикальным реакциям, включающим инициирование молекул, рост и обрыв цепи за счет столкновения с аэрозольными частицами или с другими радикалами.[ ...]
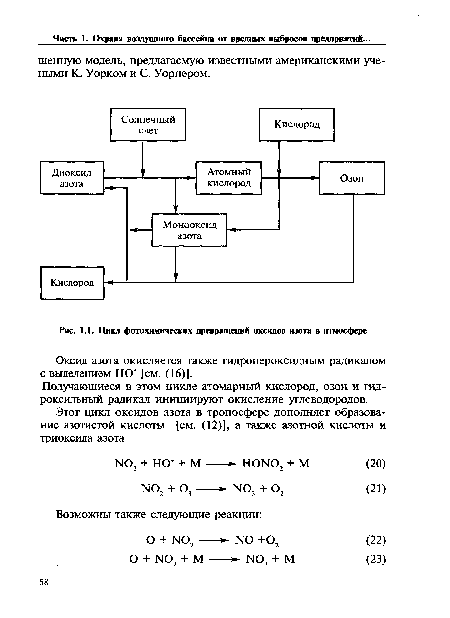
Химические превращения в атмосфере инициируются главным образом продуктами фотолиза таких молекул, как озон, кислород, вода, оксиды азота.[ ...]
Гидропероксидный радикал на высоте 5—30 км распределен примерно равномерно, с концентрациями порядка 107—108 см 3.[ ...]
При этом образуется высокоактивный атомарный кислород О, который соединяется с молекулой кислорода (в присутствии третьего тела) с образованием озона [ см. реакцию (2)].[ ...]
Оксид азота окисляется также гидропероксидным радикалом с выделением НО [см. (16)].[ ...]
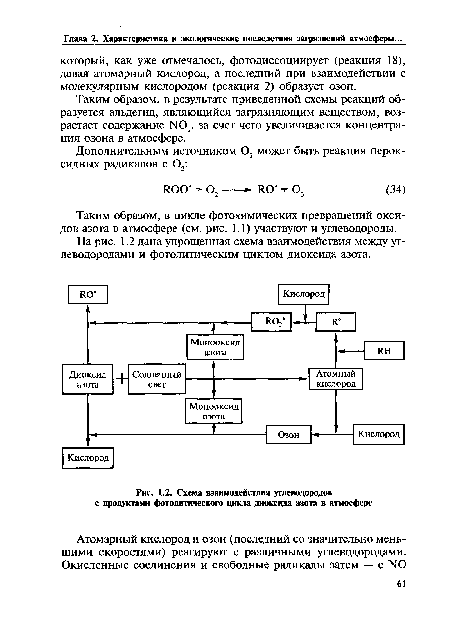
Получающиеся в этом цикле атомарный кислород, озон и гидроксильный радикал инициируют окисление углеводородов.[ ...]
Рисунки к данной главе:
| Цикл фотохимических превращений оксидов азота в атмосфере |
 |
| Схема взаимодействия углеводородов с продуктами фотолитического цикла диоксида азота в атмосфере |
 |