Наши знания о коагуляции на сегодняшний день очень ограничены по сравнению с тем, что мы знаем о следующей стадии — флокуля-ции. Объясняется это сложностью первого процесса.[ ...]
При коагуляции коллоидные частицы образуют агрегаты большего размера. Частицы можно сравнивать между собой по диаметру ¿р.[ ...]
Коллоидные частицы довольно стабильны. Одна из причин этого состоит в следующем: благодаря малому размеру таких частиц броуновское движение молекул воды оказывает на них более сильное воздействие, чем силы гравитации. Кроме того, электростатические силы отталкивания, обусловленные поверхностным зарядом коллоидных частиц, предотвращают их коагуляцию и последующее осаждение.[ ...]
Агрегация частиц в процессе коагуляции является результатом дестабилизации коллоидной системы, обычно вызываемой добавлением химических веществ. Дестабилизация может осуществляться в соответствии с несколькими механизмами, зависящими от химического состава коллоидов и химических коагулянтов. Однако понимание механизма дестабилизации, по существу, является на сегодняшний день неполным.[ ...]
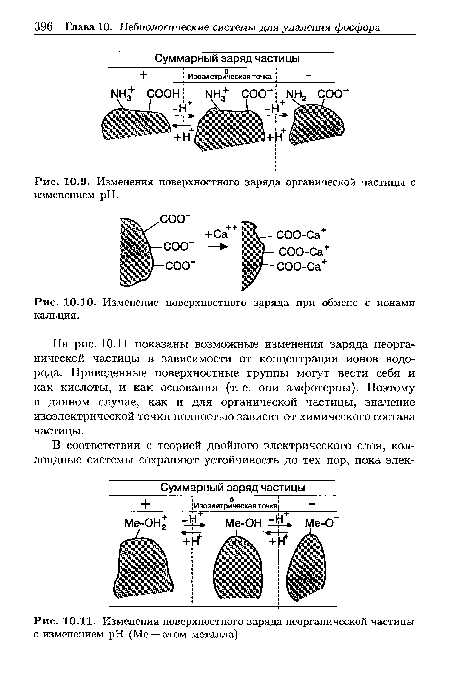
В сточной воде содержатся гидрофильные частицы — коллоидные частицы, проявляющие сильную тенденцию к связыванию или абсорбированию воды, и гидрофобные частицы — коллоидные частицы, отталкивающие воду. Весьма приближенно это можно представить так: органические коллоидные частицы являются гидрофильными, а неорганические — гидрофобными. Причина гид-рофильности органических частиц состоит в том, что на их поверхности существуют группы, способные связывать или адсорбировать воду, например аминогруппы (-1ЧН2), гидроксильные (-ОН) и карбоксильные группы (-СООН), см. рис. 10.5. Связывание или адсорбция воды происходит в результате образования так называемых водородных связей. В итоге гидрофильные частицы оказываются окруженными водной оболочкой, которая перемещается вместе с частицей. Эту оболочку называют «связанной» водой. Гидрофобные частицы подобной оболочки не имеют.[ ...]
Коллоидные частицы, содержащиеся в сточной воде, в основном заряжены отрицательно. Это можно проверить, поместив частицы в электрическое поле. Зная потенциал поля, скорости движения частиц, вязкость и т. д., можно определить так называемый дзета-потенциал, значение которого мы обсудим ниже.[ ...]
Первичный заряд частиц обусловлен диссоциацией на их поверхности концевых групп, таких как уже упоминавшиеся гидроксильные, карбоксильные и аминогруппы, и(или) адсорбцией ионов из водной фазы. Заряд гидрофильных коллоидов чаще всего определяется диссоциацией, а заряд гидрофобных частиц — адсорбцией. Под действием первичного заряда частиц к ним притягиваются противоположно заряженные ионы (противоионы), которые накапливаются вокруг поверхности частицы, тем самым частично нейтрализуя первичный заряд и создавая двойной электрический слой.[ ...]
Слой ионов, непосредственно прилегающий к частице, называют фиксированным, а окружающий его слой —диффузным. Концентрация противоионов в диффузном слое постепенно понижается от центра к периферии и в конце концов становится равной концентрации в толще воды. Схематически эти слои изображены на рис. 10.6.[ ...]
На рис. 10.7 показано изменение потенциала частицы. Граница скольжения обозначает межфазное пространство между частью жидкости, движущейся вместе с частицей, и остальной жидкостью. Потенциал, возникающий на этой границе, называют дзета-потенциалом. И, как было сказано ранее, именно его мы и измеряем, когда исследуем движение частиц в электрическом поле.[ ...]
В гидрофобных коллоидных частицах граница скольжения близка к поверхности раздела фиксированного и диффузного слоев.[ ...]
Рисунки к данной главе:
| Схематическое представление коллоидной гидрофильной белковой частицы, окруженной «связанной» водой [4]. |
![Схематическое представление коллоидной гидрофильной белковой частицы, окруженной «связанной» водой [4].](/static/pngsmall/261165688.png) |
| Схематическое представление двойного слоя ионов вокруг коллоидной частицы с отрицательно заряженной поверхностью [4]. |
![Схематическое представление двойного слоя ионов вокруг коллоидной частицы с отрицательно заряженной поверхностью [4].](/static/pngsmall/261165692.png) |
| Изменение электрического потенциала вокруг заряженной гидрофильной коллоидной частицы [4]. |
![Изменение электрического потенциала вокруг заряженной гидрофильной коллоидной частицы [4].](/static/pngsmall/261165692.png) |
| Пример распределения дзета-потенциала (а следовательно, и распределения заряда) среди частиц в сточной воде [5]. |
![Пример распределения дзета-потенциала (а следовательно, и распределения заряда) среди частиц в сточной воде [5].](/static/pngsmall/261165694.png) |
| Изменения поверхностного заряда органической частицы с изменением pH. |
 |
| Изменение поверхностного заряда при обмене с ионами кальция. |
 |
| Изменения поверхностного заряда неорганической частицы с изменением pH (Ме — атом металла). |
 |
| Взаимодействие между частицами как функция расстояния между ними [4]. Если расстояние между частицами меньше, чем а, притяжение преобладает и возможно образование первичных частиц. |
![Взаимодействие между частицами как функция расстояния между ними [4]. Если расстояние между частицами меньше, чем а, притяжение преобладает и возможно образование первичных частиц.](/static/pngsmall/261165698.png) |
Аналогичные главы в дргуих документах:
| См. далее:Коагуляция |
| См. далее:Коагуляция |
| См. далее:Коагуляция |
| См. далее:Коагуляция |