В 1873 г. Ван-дер-Ваальс на основе молекулярной модели несжимаемых шаров диаметра о, притягивающих друг друга с силой, изменяющейся обратно пропорционально четвертой степени расстояния, вывел свое удивительно простое и замечательное уравнение.[ ...]
В реальном газе в результате межмолекулярного притяжения увеличивается кинетическое давление по сравнению с давлением в идеальном газе. Так как сила межмолекулярного притяжения пропорциональна / 4, то им обусловлено дополнительное давление обратно пропорциональное шестой степени расстояния или квадрату концентрации А//К.[ ...]
Следствие из этого закона может быть сформулировано следующим образом: все вещества кипят при одних и тех же относительных давлениях и температурах. Или еще — относительные объемы всех веществ одинаковы при одних и тех же относительных давлениях и температурах.[ ...]
Математическое и экспериментальное исследование этого уравнения показали, что поправки Ван-дер-Ваальса обладают глубоким физическим смыслом. Они не только качественно описывают изменения свойств системы, определяющих фазовый переход газ-жидкость, но и форму критической области. Кроме того, если силы притяжения нельзя рассматривать постоянными из-за близкодействия, обусловленного спецификой строения молекул, то уравнение Ван-дер-Ваальса допускает следующее приближение с учетом члена 1/Т2.[ ...]
Таким образом, уравнение Ван-дер-Ваальса не описывает свойства жидкостей при нормальных условиях даже в первом приближении из-за того, что в жидкости при Г «1 первые два члена практически полностью взаимно уничтожаются и давление определяется последующими членами разложения (см. (2.23)).[ ...]
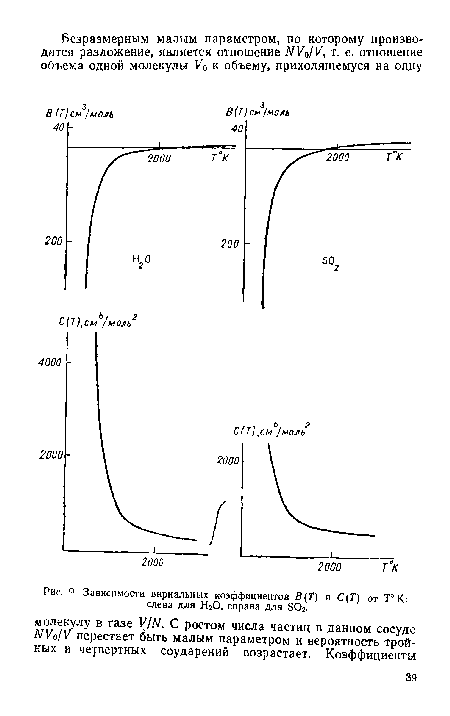
Если В(Т) отрицательно, то е и‘ кТ> и U12<0 (см. (2.29)), что соответствует притяжению молекул. С ростом температуры В(Т) уменьшается по модулю и при каких-то температурах принимает значение, равное нулю. При дальнейшем росте температуры В(Т) становится >0, как это иллюстрирует зависимость В(Т). Для воды, как и для S02 В(Т)=0 при 7 2000°К. Исследования, выполненные при указанных температурах и давлениях, не характеризуют близких расстояний взаимодействия, и на основании данных относительно В (Т) (рис. 9) можно получить сведения только относительно той части потенциала, которая характерна для газа и далека от минимума потенциала, достигаемого в жидкости.[ ...]
Зависимость С(Т) от Т находится с помощью следующей процедуры. Для каждой температуры Т определяется тангенс угла наклона зависимости (PV/RT—1)У от 1/V, который и представляет собой значение С(Т) для данной Т. Таким образом, находят С(Т) для разных температур и затем строят зависимость С(Т) от Т.[ ...]
Зависимость С(Т) от Т для Н20 и SO2 представлена на рис. 9. Как видно, третьи вириальные коэффициенты, как и вторые, не имеют принципиальных различий для двух газов из молекул, обладающих приблизительно одинаковыми дипольными моментами.[ ...]
Одно из наиболее удачных эмпирических уравнений состояния для пара было предложено Кием (1949). Оно содержит пять постоянных, помимо газовых, для температур ниже критической и еще три дополнительные постоянные для более высоких температур.[ ...]
Рисунки к данной главе:
| Зависимости внрнальных коэффициентов В (Г) и С(Т) от Т° К |
 |