Одна из основных задач при определении технологического режима адсорбционной установки — это расчет условий адсорбционного равновесия, т. е. расчет изотермы адсорбции. Зависимость количества адсорбированного вещества от равновесной концентрации в растворе необходимо знать при расчете кинетики и динамики адсорбции, а также при расчете удельного расхода адсорбента при любом способе технологического оформления адсорбционного процесса.[ ...]
Остановимся подробнее на приведенных положениях.[ ...]
При изучении адсорбции из растворов также можно было ожидать аддитивности энергий адсорбции, так как энергия сольватации (гидратации) аддитивно складывается из энергий сольватации отдельных элементов структуры молекулы.[ ...]
Теоретическое вычисление уменьшения свободной энергии при адсорбции из растворов до сих пор практически невозможно, особенно для случая адсорбции веществ, растворенных в воде. Поэтому при адсорбции растворенных веществ термодинамические величины, характеризующие адсорбционное равновесие, определяют экспериментально. Экспериментальное определение величины —АР° описано нами подробно в [35, 36].[ ...]
Эти же величины можно найти как произведение ван-дер-ваальсовской площади проекции адсорбированной молекулы на ван-дер-ваальсовский размер ее, нормальный к плотности проекции (0, т. е. на так называемую толщину молекулы [45].[ ...]
При вычислении константы адсорбционного равновесия в качестве стандартного выбрано состояние бесконечного разбавления в растворе в адсорбционной фазе, когда заполнение адсорбционной фазы стремится к нулю.[ ...]
При исследовании адсорбции из растворов условием стандартного состояния является отсутствие взаимодействия между молекулами растворенного вещества, а также с молекулами воды, которое нарушило бы ее структуру. Этому стандартному состоянию соответствует бесконечное разбавление органического компонента водой в равновесном растворе и адсорбционной фазе.[ ...]
Предельное значение коэффициента активности, таким образом, можно рассчитывать по константе адсорбционного равновесия и растворимости в тех случаях, когда диполь — дипольное отталкивание молекул в адсорбционной фазе отсутствует или незначительно (при малых ди-польных моментах молекул).[ ...]
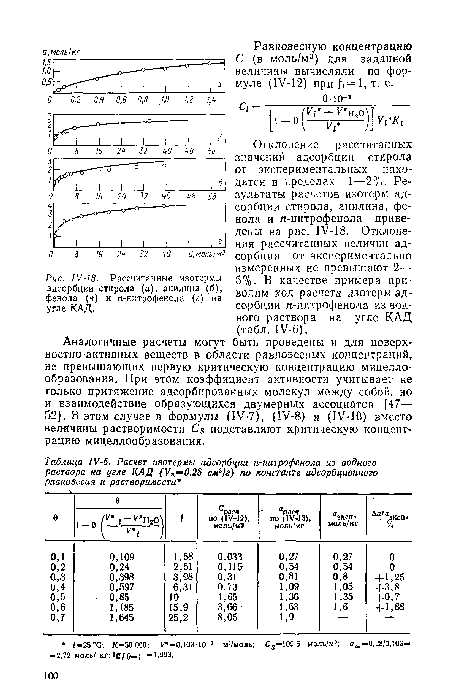
Отклонение рассчитанных значений адсорбции стирола от экспериментальных находится в пределах 1—2%. Результаты расчетов изотерм адсорбции стирола, анилина, фенола и п-нитрофенола приведены на рис. IV-18. Отклонения рассчитанных величин адсорбции от экспериментально измеренных не превышают 2— 5%. В качестве примера приводим ход расчета изотерм адсорбции п-нитрофенола из водного раствора на угле КАД (табл. 1У-6).[ ...]
Рисунки к данной главе:
| Зависимость 1§ } от в для фенола, адсорбированного иа угла КАД (линия рассчитана по растворимости). |
 |
| Зависимость 1ц (1 от 0 для молекул анилина, адсорбированных на угле КАД (линия рассчитана по растворимости). |
 |
| Зависимость ^ от 0 для молекул нитробензола, адсорбированного на угле КАД (штриховая линия рассчитана по растворимости). |
 |
| Рассчитанные изотермы адсорбции стирола (а), анилина (б), фенола (а) и п-нитрофенола (г) на угле КАД. |
 |