ПОКАЗАТЕЛИ КАЧЕСТВА ВО-ДЬ4 — совокупность биологических и физико-химических характеристик воды: трофосапробности, солености и жесткости, водородного показателя pH, концентрации вредных веществ.[ ...]
Водородный показатель исходного бидистиллята был равен 6,36, обработанного магнитным полем ■— 6,56, подвергавшегося кипячению •— 6,67.[ ...]
Водородный показатель (pH) определяет концентрацию в воде ионов водорода и показывает ее кислотность или щелочность. У пунктов культурно-бытового водопользования показатель pH не должен превышать 6,5...[ ...]
Водородный показатель pH должен быть в пределах 6,5—8,5.[ ...]
Водородный показатель pH большинства природных вод близок к 7. Постоянство pH воды имеет большое значение для нормального протекания в ней биологических и физико-химических процессов, приводящих к самоочищению. Для воды хозяйственно-питьевого назначения он должен находиться в пределах 6,5—8,5.[ ...]
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (pH) — величина, характеризующая концентрацию (активность) ионов водорода в растворах; численно равна отрицательному десятичному логарифму концентрации (активности) ионов водорода [Н‘], выраженной в молях на литр: pH = - [Н ]. Водные растворы могут иметь pH от 1 до 14; нейтральные —- 7; кислые <7; щелочные >7.[ ...]
Водородный показатель выражают величиной pH, представляющей собой десятичный логарифм концентрации ионов водорода, взятый с обратным знаком; pH определяют в интервале от 1 до 14. В большинстве природных вод pH находится в пределах от 6,5 до 8,5 и зависит от соотношения концентраций свободного диоксида углерода и бикарбонат-иона. Более низкие значения pH могут наблюдаться в кислых болотных водах. Летом при интенсивном фотосинтезе pH может повышаться до 9,0. На величину pH влияет содержание карбонатов, гидроокисей, солей, подверженных гидролизу, гуминовых веществ и т. п. Данный показатель является индикатором загрязнения открытых водоемов при выпуске в них кислых или щелочных сточных вод.[ ...]
Водородный показатель pH. Важным показателем чистоты и свойств состава воды является pH. Согласно ГОСТ 2874-—73 допускаются колебания pH в пределах 6,5ч-8,5. Отклонение pH от этих значений указывает на нарушение стабильности воды и возможное ее загрязнение.[ ...]
| Водородный показатель pH раствора при разном содержании сульфата алюминия при | 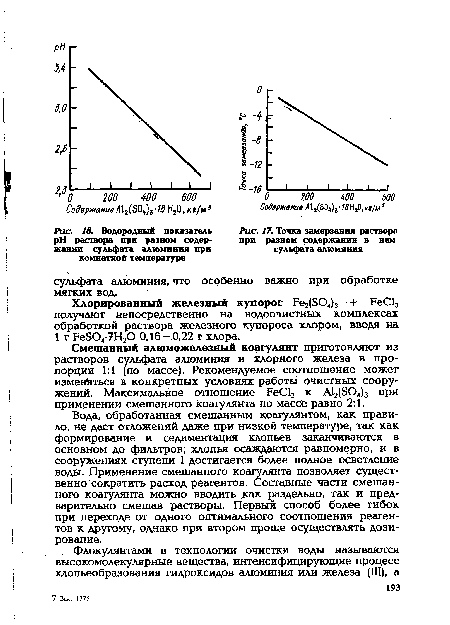 |
Помимо водородного показателя, существуют другие характеристики степени кислотности или щелочности раствора, такие как кислотность и щелочность.[ ...]
Реально водородный показатель дождевой воды, отобранной в разных районах мира, лежит в пределах 2 < pH < 9. "Раскисление" происходит обычно при захвате каплями дождя некоторых видов аэрозолей - частиц карбонатных пород или морских аэрозолей (морская вода в силу своего ионного состава имеет щелочную реакцию, что отражается на составе образующихся из нее аэрозолей). На рис. 6.1 показаны компоненты, определяющие значения pH осадков.[ ...]
Измеряют водородный показатель пробы исследуемых растворов при каждой концентрации (и контрольных) в конце испытания.[ ...]
Концентрация водородных ионов. Водородный показатель pH, оп-педеляемый по формуле (2.4), используется для выражения степени кислотности или щелочности раствора. Концентрацию водородных ионов чаще всего измеряют с помощью прибора, дающего показания непосредственно в единицах pH (рис. 2.5). Прибор снабжен стеклянным и каломельным электродами. Для тарирования счетчика используют заранее приготовленные стандартные растворы.[ ...]
Регулирование водородного показателя не должно вызывать химической реакции с веществом, подлежащим исследованию (например, выпадение осадка, комплексообразование), и не должно существенно изменять концентрацию раствора исследуемого вещества.[ ...]
РЕАКЦИЯ СРЕДЫ — водородный показатель (pH) среды (почвы, воды). Реакция почв — один из важнейших эдафических факторов, влияющих на растительность и почвенные микроорганизмы. Напр., в сильнокислых почвах (pH = 4,5—5,5) развиваются сфагновый мох, карликовая береза и т.п.[ ...]
Гидрохимические показатели дают более точную, количественную информацию о качестве воды в водном объекте, чем органолептические, однако требуют оборудования, которое часто бывает очень сложным. Далее мы поговорим о простейших, но наиболее типичных показателях: водородном показателе (pH), жесткости и т.д.[ ...]
Одним из важнейших показателей, определяющих качество воды, является водородный показатель (pH) среды, который оказывает существенное влияние не только на жизнь рыб в водоеме, но и на состояние всего биоценоза в целом. Нормальное протекание жизненных процессов у большинства водных организмов происходит при нейтральной или слабощелочной реакции среды. В кислой среде минерализация органических остатков ослабевает и снижается фотосинтетическая деятельность организмов, в результате при достаточном обеспечении органическими веществами водоем становится малопродуктивным.[ ...]
Аномалии в изменении водородного показателя среды при фазовом переходе наблюдались при нагревании миозина в окрестности температурной точки 41° С[184].[ ...]
По органолептическим показателям колодезная вода в условиях длительного контакта с прибором с активной водой (в течение 2-х месяцев) не приобретала посторонних запахов и привкусов. Цветность и мутность воды выраженно не изменялись, по сравнению с фоновыми показателями. Водородный показатель обработанной воды несколько (на 0,3-0,4 единицы pH) смещался в щелочную сторону, по сравнению с исходной водой. В контрольной воде pH также смещалась в щелочную сторону, но эти изменения были менее выраженными (в пределах 0,2 ед. pH). В колодце № 2 pH наоборот сдвигалась на 0,35 единиц в кислую сторону, однако все колебания pH во всех колодцах были в пределах нейтральной реакции 6,84-7,57. И соответственно менялась щелочность воды.[ ...]
| График колебания водородного показателя (pH) сточных вод по часам суток. | 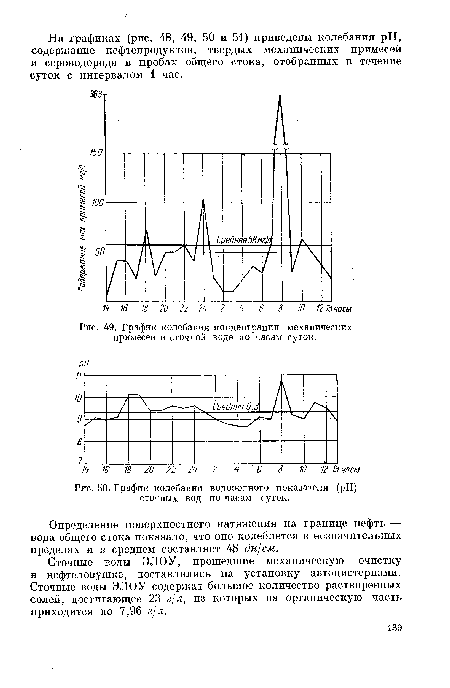 |
Примечание — Колебания водородного показателя в течение испытания могут оказывать значимое влияние на результаты, и поэтому установлен предел в 1,5 единицы. Колебания водородного показателя, однако, должны быть настолько низкими, насколько это достижимо, например, за счет непрерывного встряхивания в течение испытания.[ ...]
Теории’и практике измерения водородного показателя посвящено много специальных работ [10—14]. Здесь мы не останавливаемся на изложении электрохимических основ современных автоматических рН-метров.[ ...]
Подобное различие в величинах водородного показателя свидетельствует о том, что при обработке происходит инверсия мезогенных свойств и фазовой прочности ион-кристаллических ассоциатов, проявляющаяся в вытеснении более подвижных ассоциатов отрицательной полярности в центральную часть объема. После этого данные ассоциаты за счет кооперативного преобразования превращаются в микропузырьки. Такое фазовое состояние воды после обработки, вероятно, вызвано действием акустической волны на воду в электромагнитном поле, при происходит котором изменение фазовой прочности униполярных ассоциатов в электромагнитном поле с последующим распадом ассоциатов положительной полярности под акустическим воздействием.[ ...]
Перечень наблюдаемых ингредиентов и показателей качества воды на пунктах стационарной сети определяется главным образом химическим составом и объемом сточных вод, их токсичностью и другими условиями, которые оговариваются требованиями со стороны потребителей воды. Это обусловливает характер и направленность программ наблюдений пунктов стационарной сети. Тем не менее определение показателей качества воды, регламентируемых для санитарно-бытового и рыбохозяйственного водопользования, является обязательным для всех пунктов сети и входит общую программу. К, таким показателям относятся: температура воды, взвешенные вещества, минерализация, цветность воды, мутность, диоксид углерода, водородный показатель, биохимическое потребление кислорода в течение 5 сут, запахи, основные ионы, биогенные компоненты и такие широко распространенные загрязняющие вещества, как нефтепродукты, детергенты, летучие фенолы, пестициды, соединения тяжелых металлов.[ ...]
Важной характеристикой сточных вод является водородный показатель pH. Величина pH характеризует степень кислотности водных растворов. Химически нейтральные стоки имеют нейтральную реакцию (pH = 7,0). Меньшее или большее значение pH указывает соответственно на кислую или щелочную реакцию .сточных вод.[ ...]
Во всех случаях, наблюдавшихся в лаборатории ХИЭИ, водородный показатель растворов в результате магнитной обработки возрастал на 0,05—0,50, а в некоторых случаях (растворы хлорида кобальта) даже на 0,8—1,0 единиц pH.[ ...]
КИСЛЫЕ ОСАДКИ — атмосферные осадки в виде дождя или снега, подкисленные (величина водородного показателя pH <5 ,6) из-за растворения в них кислотообразующих промышленных выбросов (загрязняющих веществ): S02, NOx, НС1 и др. К.о. вызывают модификацию (подкисление или закисление) почвы, водоемов и приводят к повреждению живых организмов (гибель рыбы, снижение прироста лесов и т.д.).[ ...]
Температура осадков из двухъярусных отстойников близка к температуре сточной жидкости, водородный показатель равен 7—8.[ ...]
Кислотность или щелочность пластовой воды количественно характеризуется концентрацией водородных ионов, причем указывается ее логарифм, взятый с обратным знаком, который называется водородным показателем и обозначается pH (pH = (Н+).[ ...]
Физические свойства воды — плотность, удельная теплоемкость, растворенные в ней соли и газы, водородный показатель pH, а также ее движение являются для обитателей водной среды экологическими факторами их приспособления и выживания.[ ...]
Из курса химии мы знаем, что в диапазоне температур 295—298К pH нейтрального раствора равен или близок 7; если водородный показатель ниже этих значений, растворы, в данном случае вода осадков, являются кислотными, при более высоких — щелочными.[ ...]
Активность ионов водорода характеризует кислотные или щелочные свойства водных растворов и определяется водородным показателем pH. Чистая химически нейтральная вода имеет pH = 7 при температуре 22 °С, у кислых растворов pH < 7, У щелочных pH > 7. pH измеряется косвенно по ЭДС между измерительным и сравнительным электродами.[ ...]
Пределы измерения величины pH от минус 1 до плюс 14. Величина, представляющая собой логарифм обратного значения концентраций водородных ионов, называется водородным показателем и обозначается символом pH (pH = - [Н+]). При этом нейтральная реакция стоков соответствует pH = 7, кислая pH < 7, а щелочная pH < 7 (от 7 до 14).[ ...]
Для каждого конкретного случая титрования подбирают индикатор, позволяющий фиксировать точку эквивалентности в различных областях водородного показателя среды pH. Концентрация ионов Н+ и ОН- в водном растворе одинакова (10 7 моль/дм3); логарифм этого числа с обратным знаком называется водородным показателем и обозначается pH. Если рН=7 — среда нейтральная, pH <7 — кислая, pH >7 — щелочная.[ ...]
Загрязнение воды связано не только с присутствием в ней токсичных или дурнопахнущих веществ, но и с изменением ряда других физико-химических показателей. Для водных экосистем имеют значение такие экологические факторы, как содержание в воде взвешенных веществ, ее минеральный состав, растворенный кислород, температура, окраска, водородный показатель pH и др. Состав и свойства воды в створах водопользования ни по одному из таких показателей не должны превышать установленных нормативов. В случае использования водного объекта для различных нужд приоритетными являются более жесткие требования в ряду одноименных показателей.[ ...]
Факторами, определяющими эффективность дезинфицирующего средства, являются его вид, форма и необходимая концентрация, время его действия, а также водородный показатель воды, концентрация микроорганизмов, их возраст, размеры и вид.[ ...]
Клетки водорослей следует держать во взвешенном состоянии путем встряхивания, помешивания или аэрирования, чтобы улучшить газообмен и сократить колебания водородного показателя в исследуемых растворах.[ ...]
При содержании С02 в атмосфере, равном 340 млн 1 , и при температуре 20 °С расчетная концентрация ионов водорода составляет 2,3 ■ 10 6 г-ион/л, что соответствует pH = 5,6. Поэтому "кислотными" принято называть атмосферные осадки с водородным показателем ниже этого значения.[ ...]
Радиус иона Н+ составляет 1,32 А, это — «тонкий» ион, и он попадает в полости каркаса, стабилизируясь в каркасе. Радиус иона ОН- равен радиусу полости каркаса, этот ион оказывается в растворе в избытке, создавая щелочную среду. Значит, должен возрастать водородный показатель pH.[ ...]
В контрольные сосуды следует добавить только воду, концентрат питательных веществ и инокулум без исследуемого вещества. Затем приготавливают по три репликата каждой концентрации исследуемого вещества и шесть идентичных контрольных сосудов. Измеряют водородный показатель пробы исследуемых растворов при каждой концентрации и контрольной группы.[ ...]
Кислотность определяется концентрацией ионов водорода в водном растворе. Для удобства кислотность раствора выражают более удобным способом: вместо концентрации ионов водорода указывают ее десятичныи логарифм взятый с обратны знаком Эта величина называется водородным показателем и обозначается pH. В нейтральном растворе pH = 7; в кислы растворах pH меньше 7, и чем ниже это значение, тем кислее раствор. В щелочных растворах pH больше 7; максимально щелочность соответствует pH = 14.[ ...]
На существующей в настоящее время сети станций глобального и регионального мониторинга программа измерений включает в себя определение таких параметров, как кислотность, электропроводность, содержание катионов (№, К, М§, Са) и анионов (804, С1, N03, НС03). Для оценки степени кислотности осадков используется водородный показатель pH.[ ...]
При уменьшении дозы извести шахтная вода имеет высокую карбонатную щелочность. При передозировке извести увеличивается общая щелочность и значение pH.[ ...]
В воде, подверженной акустической обработке вне микроорганизмов в течение -100 минут наблюдается уменьшение равновесных значений концентрации ион-радикалов в 2,5 раза (по сравнению с контролем без акустической обработки), что указывает на активную электрохимическую роль малоинтенсивных акустических полей. Одновременно с изменением концентрации ион-радикалов в воде происходит увеличение водородного показателя среды (от 5,39 - в исходной воде до 5,80 - после двухчасового воздействия акустического генератора) и уменьшение величины окислительно-восстановительного потенциала (в среднем от 200 мВ до 80-140 мВ).[ ...]
Особое внимание следует обращать на обезвреживание сточных вод термических цехов, в которых могут содержаться цианистые соединения и другие ядовитые вещества. Для очистки от цианидов применяют также марганцовокислый калий и перекись водорода. При значительных концентрациях цианид-ионов (сточные воды участков цианирования) применяют электрохимическую очистку. Для отстаивания сточных вод могут применяться горизонтальные и вертикальные отстойники с продолжительностью отстаивания не менее 2 ч. После перечисленных операций: реагентной обработки, отстаивания и в некоторых случаях фильтрования - сточные воды обычно сбрасывают в бытовую канализацию или водоем. Возврат очищенных реагентным методом и доочищенных на фильтрах сточных вод возможен лишь на неответственные операции процессов гальванических покрытий.[ ...]
Рассмотренные ранее системы автоматической (регулировки нейтрализации сточных вод значительно усложняются в случае таких изменений амплитуды значения pH, когда максимум многократно перемещается из области кислой реакции в область основной и наоборот. В таком случае для поддержания заданной степени нейтрализации сточных вод необходимо соединить две идентичные системы регулировки, из которых каждая регулирует в своей области значения водородного показателя pH сточных вод.[ ...]
С целью повышения степени очистки и уменьшения энергозатрат предлагается электрофлоташпо осуществлять в три стадии с плотностью тока на электродах на каждой стадии 1000-1200, 500-600 и 100-200. А/м соответственно при общем периоде воздействия электротоком 20-60% от общей продолжительности процесса. Такой процесс предполагает рациональные условия проведения электрофлотации. В течение первого периода происходит электрохимическая регулировка свойств жидкости -повышение и снижение водородного показателя (pH), что требует высокой плотности тока. Вторая стадия характеризуется интенсивной коагуляцией тонкодисперсных частиц, образованием флокул и их частичным всплытием, на что требуется значительно меньше энергозатрат. Третья стадия характеризуется небольшой плотностью тока - до 200 А/м% что способствует более полной флотации взвешенных частиц пузырьками газа.[ ...]
Для оценки качества воды важной характеристикой является pH. У большинства поверхностных вод pH колеблется в пределах от 6,5 до 8,5. Подземные воды иногда имеют повышенное значение pH. Кислую реакцию среды имеют рудничные воды сульфидных, колчеданных месторождений, содержащие сульфат железа (II), воды болот, в которых находится значительное количество гумусовых кислот. Обычно pH природных вод данного источника является величиной постоянной. Постоянство pH природных вод обусловлено наличием в них буферной системы, состоящей из свободной угольной кислоты и гидрокарбонатов. Поэтому заметные изменения pH могут быть показателем загрязнения воды бытовыми или промышленными стоками. Дистиллированная вода, вследствие растворения диоксида углерода из воздуха, может иметь pH до 5,7. Водородный показатель морской воды изменяется в пределах от 8,2 до 8,5.[ ...]
Производственная деятельность человека не сопровождается прямым выбросом в атмосферу сколько-нибудь значительных количеств кислот. Однако в последнее столетие, особенно во второй его половине, резко возрос поток в атмосферу газов, выступающих в качестве прямых предшественников сильных кислот, а также увеличилась скорость образования радикалов НО , и других, являющихся ускорителями естественных процессов окисления. Поэтому рассмотренная в предыдущей главе проблема изменения окислительного потенциала атмосферы имеет два аспекта: а) возрастание концентрации фотооксидантов и б) увеличение кислотности атмосферных осаждений. Обычно эти явления рассматривают вне связи одного с другим. Аргументом в пользу такого подхода могло бы служить то, что не все компоненты, ответственные за увеличение водородного показателя осаждений (например, угольная кислота, органические кислоты, галогенводороды), являются сильными окислителями. Тем не менее в механизмах образования основных компонентов кислотных осаждений (Н2304, ШЧ03, КСООН) и фотооксидантов (неорганические и органические пероксиды) имеется общность, позволяющая связывать между собой оба аспекта, основываясь не только на созвучности терминов.[ ...]