Дисперсные вещества образуют дисперсные системы, в которых различают дисперсную фазу и дисперсионную среду. Частицы дисперсной фазы как бы растворены в дисперсионной среде. Среди дисперсных систем выделяются грубодисперсные системы с частицами дисперсной фазы крупнее 0,1 мк и коллоидно-дисперсные системы (дисперсоиды) с частицами о,т 0,1 мк до 1 нм. Более мелкие дисперсные частицы обычно представляют собой крупные молекулы, которые образуют молекулярнодисперсные системы. Таким образом, коллоидное состояние характеризуется определенными размерами частиц.[ ...]
Коллоидно-дисперсные системы могут быть представлены различными комбинациями дисперсионной среды и дисперсной фазы. Для процессов почвообразования особое значение имеют коллоидно-дисперсные системы, дисперсионной средой которых является жидкость (вода), а дисперсной фазой — твердое вещество. Эти системы носят название золей или коллоидных растворов.[ ...]
Чрезвычайно мелкие размеры и соответственно большая удельная поверхность коллоидных частиц обусловливают их особые свойства. Это является одним из примеров диалектического перехода количественных признаков в новое качество.[ ...]
Большая часть твердых природных веществ обладает определенной кристаллохимической структурой. Внутри вещества ионы, атомы или группы атомов находятся в равновесном состоянии. На поверхности энергетические возможности ионов насыщены не полностью (рис. 14). Ионы кристаллической решетки, находящиеся на ее поверхности, способны воздействовать на свободные ионы — отталкивать одноименно заряженные и притягивать ионы противоположного знака. Явление притяжения под влиянием остаточных сил ионов, находящихся на поверхности твердого тела, называется адсорбцией1.[ ...]
Сила воздействия ионов, находящихся на поверхности, очень небольшая, поэтому в крупных обломках при наличии небольшой удельной поверхности влияние этих сил весьма незначительно. Однако при измельчении обломков, когда удельная поверхность возрастает, суммарный эффект воздействия поверхностных ионов становится значительным.[ ...]
Находясь в растворе, коллоидные частицы в результате взаимодействия с ионами раствора приобретают определенное строение и электрический заряд. Рассмотрим образование строения коллоидной частицы на простейшем примере.[ ...]
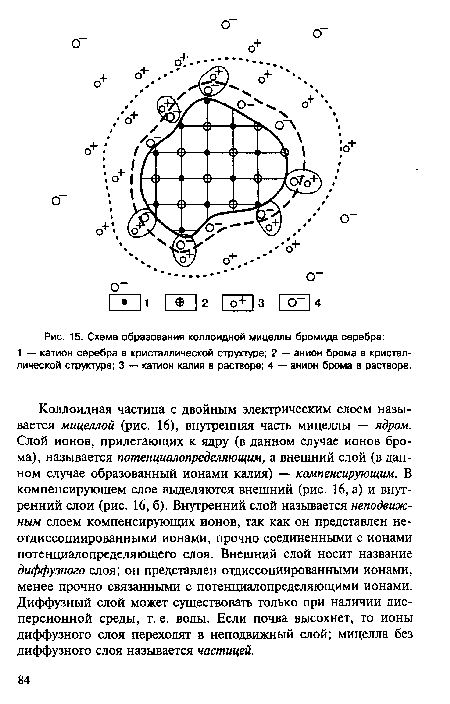
Коллоидная частица с двойным электрическим слоем называется мицеллой (рис. 16), внутренняя часть мицеллы — ядром. Слой ионов, прилегающих к ядру (в данном случае ионов брома), называется потенциалопределяющим, а внешний слой (в данном случае образованный ионами калия) — компенсирующим. В компенсирующем слое выделяются внешний (рис. 16, а) и внутренний слои (рис. 16, б). Внутренний слой называется неподвижным слоем компенсирующих ионов, так как он представлен не-отдиссоциированными ионами, прочно соединенными с ионами потенциалопределяющего слоя. Внешний слой носит название диффузного слоя; он представлен отдиссоциированными ионами, менее прочно связанными с потенциалопределяющими ионами. Диффузный слой может существовать только при наличии дисперсионной среды, т. е. воды. Если почва высохнет, то ионы диффузного слоя переходят в неподвижный слой; мицелла без диффузного слоя называется частицей.[ ...]
Строение почвенных коллоидов более сложно, чем в разобранном случае, вследствие сложной кристаллохимической структуры тонкодисперсных минералов и поглощения ионов различной валентности.[ ...]
Гели чрезвычайно широко распространены в природе, особенно в зоне гипергенеза и, в частности, в почве. Многие особенности почвы связаны с наличием гелей.[ ...]
Рисунки к данной главе:
| Схема образования коллоидной мицеллы бромида серебра |
 |
| Схема строения коллоидной мицеллы (по Н. И. Горбунову, 1963) |
 |
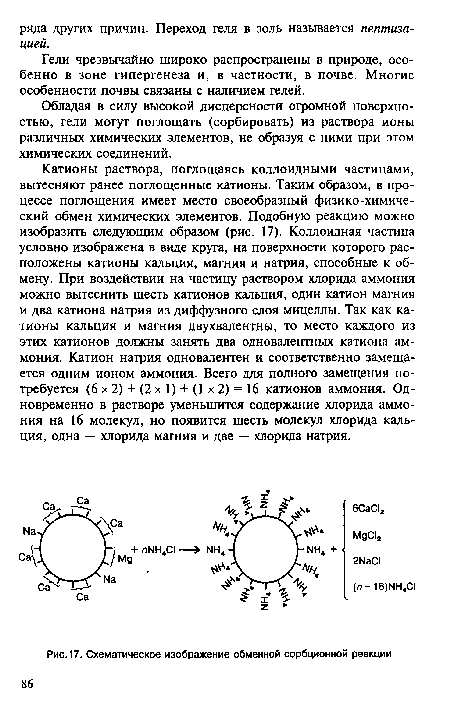
| Схематическое изображение обменной сорбционной реакции |
 |