Для очистки сточных вод используют следующие окислители: газообразный и сжиженный хлор, диоксид хлора, хлорат кальция, гипохлориты кальция и натрия, перманганат калия, бихромат калия, пероксид водорода, кислород воздуха, пероксосер-иые кислоты, озон, пиролюзит и др.[ ...]
Активность вещества как окислителя определяется величиной окислительного потенциала. Из всех известных в природе окислителей первое место занимает фтор, который, однако, из-за высокой агрессивности не может быть использован на практике. Для других веществ величина окислительного потенциала равна: для озона — 2,07; для хлора — 0,94; для пероксида водорода — 0,68; для перманганата калия — 0,59.[ ...]
В присутствии аммонийных соединений в воде образуется хлорноватистая кислота, хлорамин 1 [Н2С1 и дихлорамии ЫНС12. Хлор в виде хлорамина называется связанным «активным» хлором.[ ...]
Процесс хлорирования проводят в хлораторах периодического и непрерывного действия, напорных и вакуумных. Принципиальная схема очистки вод хлорированием показана на рис. П-59. Хлорирование проводится в емкости, включенной в систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода выводится для использования.[ ...]
Во время реакций pH поддерживают в пределах 8—11. Контроль полноты окисления производят по остаточному «активному» хлору, концентрация которого должна быть не менее 5— 10 мг/л.[ ...]
Окисление пероксидом водорода. Пероксид водорода является бесцветной жидкостью, в любых соотношениях смешивается с водой. Она может быть использована для окисления нитритов, альдегидов, фенолов, цианидов, серосодержащих отходов, активных красителей. Промышленность выпускает 85—95%-пый пероксид водорода и пергидроль, содержащий 30% Н2О2. Пероксид водорода токсичен. ПДК. в воде составляет 0,1 мг/л.[ ...]
В кислой среде более отчетливо выражена окислительная функция, а в щелочной — восстановительная.[ ...]
В кислой среде пероксид водорода переводит соли двухвалентного железа в соли трехвалентного, азотистую кислоту — в азотную, сульфиды — в сульфаты. Цианиды в цианаты окисляются в щелочной среде (pH = 9—12).[ ...]
Рисунки к данной главе:
| П-59. Схема установки для очист |
 |
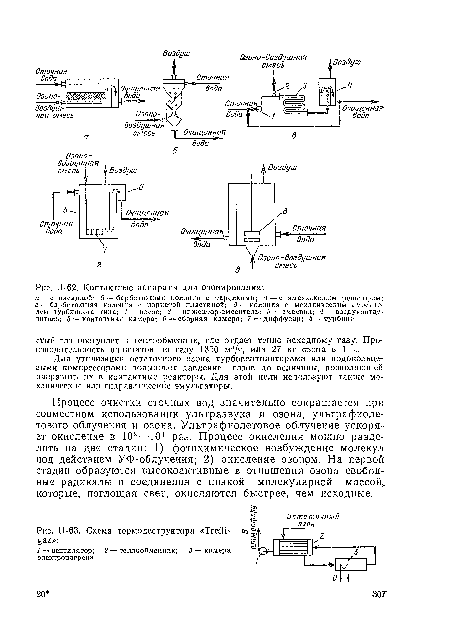
| П-62. Контактные аппараты для озонирования |
 |