Для выбора метода обезжелезиваиия необходимо установить, при каких условиях железо не может быть выделено отстаиванием и фильтрованием из водного раствора; важно знать также условия перехода закисного и окисного железа из растворенного состояния в осадок.[ ...]
Для ориентировочных расчетов ц=0,000022 Р, где Р — общее солесодержанпе воды.[ ...]
При обезжелезнвании воды двухвалентное железо может выделяться также в осадок в виде карбоната железа.[ ...]
Из формул (1.12) и (1.15) следует, что чем выше pH воды, тем меньше содержание ионов двухвалентного железа в растворе и соответственно общее содержание растворенного двухвалентного железа.[ ...]
Расчет по формулам (1.12) и (1.15) показывает, что при общем солесодержании в воде 500 мг/л и pH=9,5 в растворе останется менее 0,1 мг/л ионов закисного железа. Однако общее содержание ионов двухвалентного железа и продуктов его гидролиза в растворе будет составлять 0,85 мг/л.[ ...]
ДСр = 9,24 кДж/моль (2,21 ккал/моль).[ ...]
Формула (1.32) справедлива для равновесного насыщения воды осадком гидроокиси железа. Анализ этой формулы показывает, что с повышением pH воды общее содержание ионов трехвалентного железа и продуктов гидролиза в растворе уменьшается. Зависимость относительной концентрации ионов трехвалентного железа и продуктов ах гидролиза от pH приведена на рис. 1.1.[ ...]
Эта формула выводится аналогично формуле (1.15).[ ...]
По формуле (1.36) можно высчитать, что для общего солесодержаиня 500 мг/л и рН = 3,5 в растворе в ионной форме будет находиться 0,16 мг/л железа. Однако общее содержание растворенного железа, определенное по формуле (1.32), будет около 2 мг/л (см. рис. 1.1).[ ...]
Анализ формулы (1.43) позволяет сделать важный для технологии обезжелезивания воды вывод.[ ...]
Рисунки к данной главе:
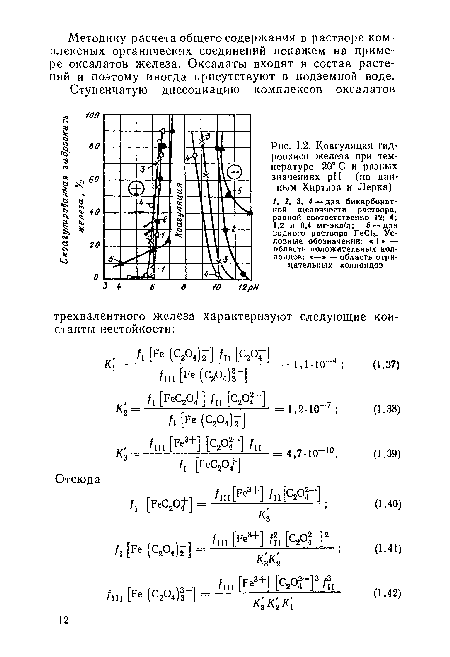
| Коагуляция гидроокиси железа при температуре 20° С и разных значениях pH (но данным Хиртиза и Лерка) |
 |