Химический анализ природной воды имеет большое значение в практике водоснабжения. Результаты анализа позволяют установить пригодность данного источника для питьевого и технического водоснабжения, наличие в воде вредных для организма загрязнений или соединений, способствующих ее коррозийной активности, вспениванию, образованию накипи и т. д.[ ...]
На основании сопоставления результатов химического анализа природной воды с требованиями, предъявляемыми к ней потребителем, можно судить о том, каким процессам очистки следует подвергнуть эту воду для улучшения тех или иных показателей ее качества.[ ...]
В связи с тем, что концентрацию воды в разбавленных растворах можно считать величиной постоянной.[ ...]
Концентрация водородных ионов такой буферной системы незначительно изменяется с разбавлением, так как pH ее определяется не концентрацией кислоты и ее соли, а отношением этих концентраций.[ ...]
Прибавление некоторых количеств кислоты или щелочи мало влияет на pH воды. Объясняется это тем, что при прибавлении к воде щелочи часть ионов Н+ , которые образовались при диссоциации угольной кислоты, связывается в малодиссоциированную воду; при этом происходит диссоциация новых количеств кислоты и восстановление первоначальной концентрации Н+. В случае прибавления к воде кислоты избыточные ионы водорода связываются с НС03 в малодиссоциированную угольную кислоту, в результате чего концентрация Н+ в системе изменяется очень незначительно.[ ...]
Хотя емкость бикарбонатной буферной смеси в природной воде не очень велика, она все же позволяет мало изменять pH воды при различных процессах ее обработки (хлорировании, коагулировании и т. д.).[ ...]
Окисляемость воды. Наличие в природных водах органических и некоторых легкоокисляющихся неорганических примесей (сероводорода, сульфитов, закисного железа и др.) обусловливает определенную величину окисляемости воды.[ ...]
Наименьшей величиной окисляемости ( 2 мг/л 02) характеризуются артезианские воды. Окисляемость грунтовых вод зависит от глубины их залегания. Грунтовые незагрязненные воды имеют окисляемость, близкую к окисляемости артезианских вод. Окисляемость чистых озерных вод в среднем составляет 5—8 мг/л кислорода; в болотных водах в некоторых случаях она достигает 400 мг/л, а в речной воде колеблется в широких пределах, доходя до 60 мг/л и более. Высокой окисляемостью воды отличаются реки, бассейны которых расположены в болотистых местностях.[ ...]
Окисляемое!ь природных вод, особенно поверхностных, не является постоянной величиной. Изменение химической характеристики поступающих в воду веществ меняет показатель их окисляемости. Повышенная окисляемость воды свидетельствует о загрязнении источника и требует применения соответствующих мероприятий по его охране при использовании для водоснабжения. Внезапное повышение окисляемости воды служит признаком загрязнения ее бытовыми стоками; поэтому величина окисляемости — важная гигиеническая характеристика воды.[ ...]
Наиболее полное окисление (90—95%) содержащихся в природных водах органических веществ достигается при замене перманганата бихроматом (бихроматная окисляемость). Высокая степень окисления, достигаемая при этом методе, позволяет применять его для количественного определения органических веществ в воде [59].[ ...]
Рисунки к данной главе:
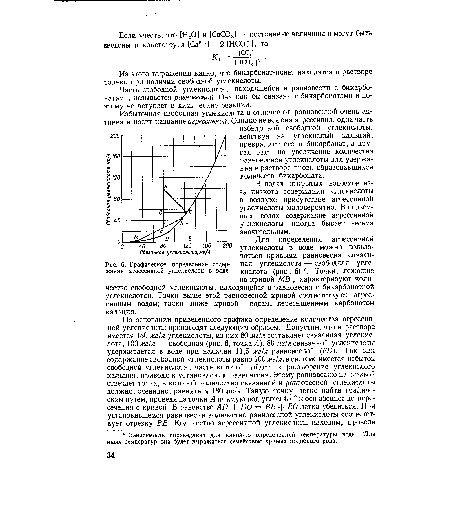
| Графическое определение содержания агрессивной углекислоты в воде. |
 |