Активная реакция, обозначаемая показателем pH, характеризует концентрацию водородных ионов, которая определяет кислотность или щелочность сточных вод. Для оненки характера загрязнений показатель pH имеет большое значение, т. к. характеризует агрессивность стоков к материалу канализационных труб, насосных станций, очистных сооружений.[ ...]
Молекулы воды подвергаются диссоциации с образованием иолов водорода Н и ионов гидроксилов ОН. В чистой воде степень концентрации водородных и гидроксильных ионов равна и составляет в 1 л 10 7 г. Концентрация водорода (потенциал водорода) рН = 1: 107= Ю-7; 1(? рН = — 7 lg 10 = — 7. Принимают pH = 7.[ ...]
При pH = 7 реакция нейтральная, при рН>7 — щелочная, при рН<7 — кислотная. Бытовые сточные воды имеют р.Н = = 7,2- 7,3, производственные — от сильнокислых до сильнощелочных значений.[ ...]
Сильные кислоты (соляная, азотная, хлорная, хлористая) и сильные щелочи (гидраты окислов щелочных и щелочноземельных металлов) диссоциируются полностью, и для них pH выражается формулой pH = — С.[ ...]
Нормальным называется раствор, содержащий в 1 л 1 г-экв растворенного вещества, т. е. количество вещества, соответствующее его молекулярной массе, отнесенной к единице валентности или 1 атому водорода.[ ...]
При большем содержании свободной углекислоты вода становится агрессивной. Количества равновесной углекислоты и соответствующие ей количества бикарбонатной углекислоты приведены ниже.[ ...]
Содержание бикарбонатной углекислоты на 1 мг-экв/л карбонатной жесткости составляет 44 мг/л.[ ...]
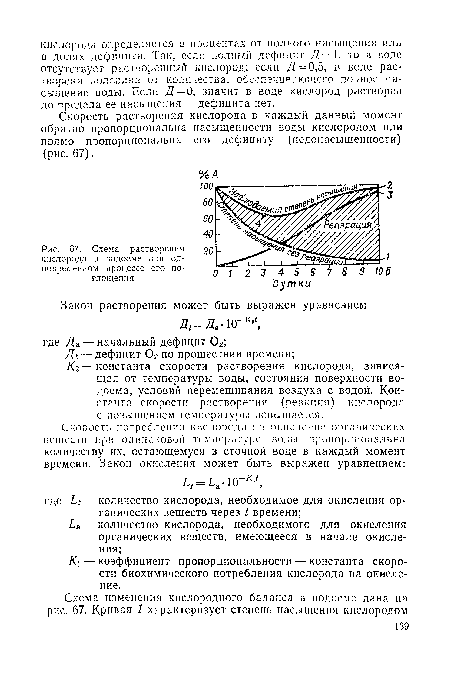
Рисунки к данной главе:
| Схема растворения |
 |