Молекула вещества, как известно, является электроней-тральной; однако положительные и отрицательные заряды в ней могут быть размещены пространственно неравномерно. Если центры тяжести положительных и отрицательных зарядов пространственно не совпадают, то вокруг молекулы воз-никает электросиловое поле; такой случай наблюдается при ионной и полярных связях. При совпадении центров тяжести зарядов электросиловое поле не образуется; атомы молекулы в этом случае находятся в неполярной связи.[ ...]
Величина электросилового поля полярных молекул харак-теризуется дипольным моментом, представляющим собой произведение элементарного электрического заряда на расстояние между центрами положительных и отрицательных зарядов.[ ...]
При растворении в воде вещества, обладающего ионной связью, молекулы воды ориентируются вокруг положительно и отрицательно заряженных ионов растворяемого вещества. В силу такой ориентации молекул воды силовое поле каждого из ионов ослабляется, что ведет к отрыву их друг от друга и возникновению в растворе положительно заряженных ионов — катионов и отрицательно заряженных ионов — анионов.[ ...]
Способность различных веществ образовывать в растворе ионы неодинакова. Молекулы таких веществ, как электролиты (например, соли), распадаются на ионы полностью; молекулы других распадаются частично, третьи (неэлектролиты) совершенно не образуют ионов.[ ...]
Способность веществ к образованию в растворе ионов характеризуется степенью диссоциации (или степенью ионизации) а, которая определяется отношением числа диссоциированных молекул к общему числу растворенных молекул этого вещества. Степень диссоциации зависит от природы вещества, концентрации раствора и его температуры (табл. 1-5).[ ...]
В зависимости от того, как электролиты распадаются на ионы — полностью или частично, их разделяют на сильные и слабые. К сильным электролитам относятся вещества, которые в 0,1 н. растворе диссоциированы больше, чем на 30%, остальные электролиты — к слабым.[ ...]
К сильным электролитам относятся почти все соли, вне зависимости от того, какой кислотой и каким основанием они образованы; кислоты же и основания могут быть как сильными, так и слабыми электролитами. К сильным, например, относятся: азотная, соляная, серная и ряд других неорганических кислот и такие основания, как едкие щелочи (едкий натр, едкое кали и т. д.); все органические кислоты (например, угольная, уксусная и т. д.), водный раствор аммиака, а также большинство органических оснований (амины, пиридиновые основания и т. д.) — слабые электролиты.[ ...]
Большинство растворенных в воде веществ находится В виде ионов, связанных между собой силами электростатического взаимодействия; каждый из них находится, кроме того, под воздействием диполей воды. Это воздействие тем больше, чем больше концентрация ионов в растворе и чем больше их заряд. Электростатические силы взаимодействия между ионами ослабляют их способность к химическим реакциям, вследствие чего только некоторая их часть, называемая активной концентрацией, способна к реакциям.[ ...]
Величина коэффициента активности зависит от так называемой ионной силы раствора V которая характеризует степень влияния электростатических сил между ионами и зависит от общего количества находящихся в растворе ионов и их валентности.[ ...]
Рисунки к данной главе:
| Зависимость соотношений ССЬ, |
 |
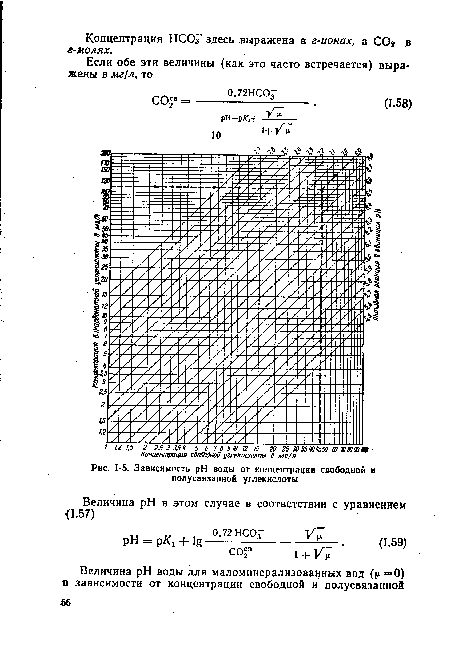
| Зависимость pH воды от концентрации свободной и полусвяззнной углекислоты |
 |