Согласно принципу минимума энергии система тел находится в устойчивом равновесии тогда, когда свободная энергия системы .имеет наименьшую величину. Поэтому поверхностная энергия частиц высокой степени дисперсности имеет тенденцию к уменьшению. Зто может быть достигнуто укрупнением частиц, связанным с уменьшением общей поверхности или путем концентрирования на поверхности частицы (молекул или ионов) другого вещества. Процесс концентрирования растворенного или парообразного вещества л(газа) на поверхности твердого вещества или жидкости называется сорбцией. Вещество, на котором идет сорбция, называется сорбентом, а сорбируемое вещество — сорбатом. Сорбция, происходящая на поверхности вещества, называется адсорбцией, а сопровождающаяся проникновением поглощаемого вещества внутрь поглотителя— абсорбцией. При этом поглощенное вещество называется сорбтивом.[ ...]
Сорбция, сопровождающаяся химическим взаимодействием между сорбентом и сорбатом, называется химической в отличие от физической сорбции, основанной на силах межмолекулярного взаимодействия. Химическая сорбция может ограничиваться только поверхностью сорбента или протекать во всем объеме вещества. Процесс химической сорбции, обусловленный химическим взаимодействием, может быть необратимым, в то время как при физической сорбции возможно отделение сорбированного вещества от сорбента (десорбция). Сорбция связана с уменьшением поверхностной энергии и поэтому протекает самопроизвольно и с выделением теп-.лоты.[ ...]
При наличии в сорбенте групп, способных к ионному обмену происходит взаимодействие между ионами электролита и сорбентом. В результате ионы электролита сорбируются на поверхности сорбента, а в раствор вместо них выходят ионы самого сорбента. Так как в основе этой сорбции лежит химическая реакция ионного обмена, то сорбция такого типа называется ионообменной сорбцией.[ ...]
Графически эта зависимость выражается изотермой адсорбции. Например, при сорбции фенолов активированным углем марки КАД-иодный при концентрации фенола в воде до 0,5 мг/л и 25° С уравнение (111.12) принимает вид А = 15,85С0’22, где А—количество фенолов, сорбированных углем; С — равновесная концентрация фенолов в воде, г/л.[ ...]
Коллоидные системы. Дисперсные системы с размером частиц дисперсной фазы от 1 до 100 нм (10 9 -10-7 м) называются коллоидными. По размеру частиц они занимают промежуточное положение между грубодисперсными системами и истинными растворами. Коллоидные системы являются ультрамикрогетерогенными системами. Для них характерно наличие высокоразвитой межфаз-яой поверхности, что в свою очередь обусловливает большой запас ■свободной поверхностной энергии. Это способствует тому, что коллоидные системы являются термодинамически неустойчивыми. В них сильно выражено стремление к уменьшению запаса свободной энергии. Реализация его возможна при уменьшении дисперсности частиц в результате их укрупнения или при адсорбции на их поверхности ионов или молекул, находящихся в дисперсионной среде. Особые свойства коллоидных систем обусловлены размером частиц. Коллоидные частицы настолько малы, что не задерживаются обычными фильтровальными материалами, не видны в обычный микроскоп, не оседают под действием силы тяжести. Устойчивость коллоидных растворов со временем снижается, т. е. они подвержены «старению».[ ...]
По степени интенсивности взаимодействия коллоидных частиц с дисперсионной средой различают лиофильные и лиофобные системы. Если дисперсионной средой является вода, то они называются гидрофильными и гидрофобными. В лиофильных системах наблюдается значительное взаимодействие между дисперсионной средой и дисперсной фазой, сопровождающееся образованием сольватных (гидратных) слоев. В лиофобных системах это взаимодействие проявляется незначительно.[ ...]
Частицы коллоидной степени дисперсности могут быть получены измельчением твердых и жидких веществ (диспергационные методы) или объединением молекул или ионов в агрегаты (конденсационные методы). Для процессов очистки воды имеют значение главным образом конденсационные методы. Однако при формировании состава природных вод коллоидные частицы могут образовываться в результате самопроизвольного диспергирования контактирующих с водой осадочных пород (алюмосиликатов). Малая концентрация растворенных веществ, наличие органических высокомолекулярных соединений и других примесей, экранирующих растущие кристаллы, способствуют образованию частиц коллоидной степени дисперсности труднорастворимых соединений (гидроксидов, сульфидов тяжелых металлов и др.), которые образуются в результате химических реакций.[ ...]
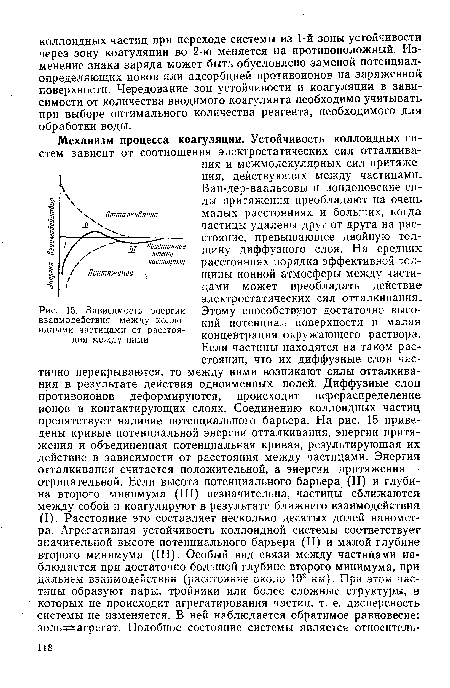
В зависимости от соотношения плотностей частиц дисперсной фазы и дисперсионной среды более крупные частицы оказываются в нижней части сосуда (при р>ро) или концентрируются в верхних слоях (при р<ро). Потеря кинетической (седиментационной) устойчивости сопровождается разрушением коллоидной системы.[ ...]
Оптические свойства коллоидных систем. Поскольку размер коллоидных частиц меньше длин световых волн видимой части спектра, то поглощенная энергия вновь испускается частицами в различных направлениях, поляризованные частицы как бы становятся новыми источниками излучения. Рассеяние света является характерным свойством коллоидных систем и подтверждает их гетерогенность. Интенсивность светорассеяния усиливается при наличии крупных частиц (но с диаметром не более Уго длины волны света), при коротковолновом излучении и при значительном отличии показателей преломления дисперсной фазы и дисперсионной среды. Коллоидные растворы поглощают монохроматический свет, причем максимум поглощения зависит от размера частиц. С уменьшением их диаметра этот максимум смещается в коротковолновую часть спектра.[ ...]
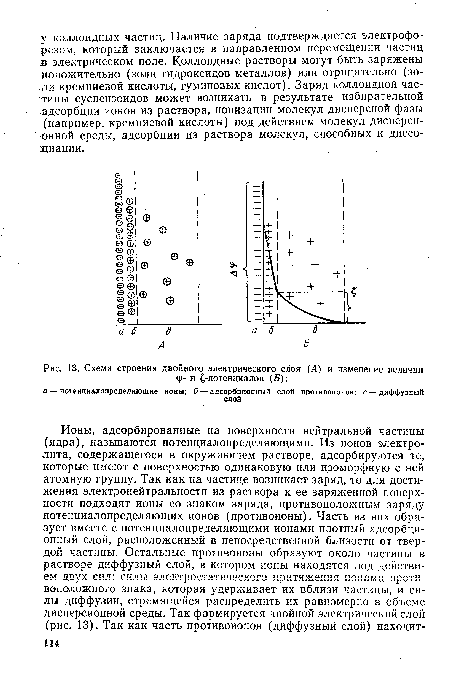
Толщина адсорбционного слоя составляет 10-7—10“8 см, а диффузного — порядка 10 4 см. Под воздействием внешних факторов возможно изменение толщины диффузного слоя и количества ионов, содержащихся в нем.[ ...]
Рисунки к данной главе:
| Схема строения двойного электрического слоя (Л) и изменение величин |
 |
| Строение коллоидной частицы кремниевой кислоты |
 |
| Зависимость энергии взаимодействия между коллоидными частицами от расстояния между ними |
 |
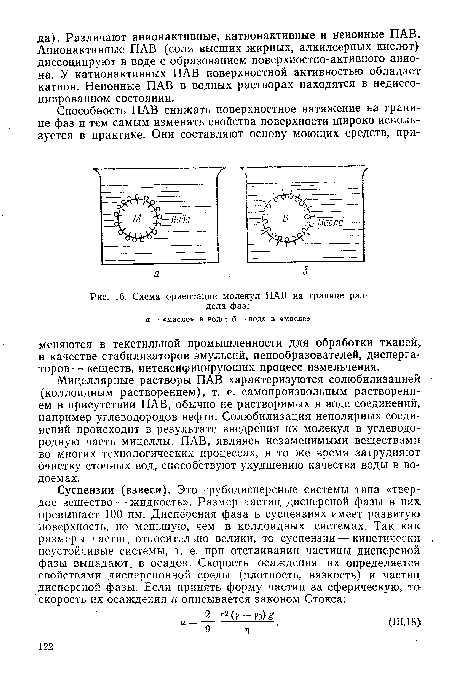
| Схема ориентации молекул ПАВ на границе раздела фаз |
 |