При образовании растворов, наряду с физическими процессами распределения молекул растворенного вещества среди молекул растворителя, происходят химические процессы.[ ...]
Молекулы растворенного вещества взаимодействуют с растворителем, образуя сложные комплексы, которые называются сольватами (от латинского solvere — растворять). Если растворителем является вода, то эти соединения называются гидратами. Сольваты многих веществ выделены из раствора в твердом виде. Доказательством существования этих соединений в растворе служит изменение теплового эффекта растворения, иногда изменение объема раствора и даже его цвета.[ ...]
При растворении твердого вещества происходит разрушение кристаллической решетки растворяемого вещества и образование сольватов. Первый процесс идет с поглощением, а второй — с выделением энергии. Конечный результат теплоты растворения равняется сумме тепловых эффектов этих процессов. Он может быть положительным и отрицательным. Например, при растворении одного моля азотнокислого аммония ЫН4ЫОз поглощается 6,4 ккал, а при растворении одного моля едкого кали КОН выделяется 12,8 ккал тепла.[ ...]
Следовательно, в растворе молекулы растворителя связаны в комплексы с растворенным веществом, поэтому в нем концентрация свободных молекул растворителя меньше, чем в чистом растворителе.[ ...]
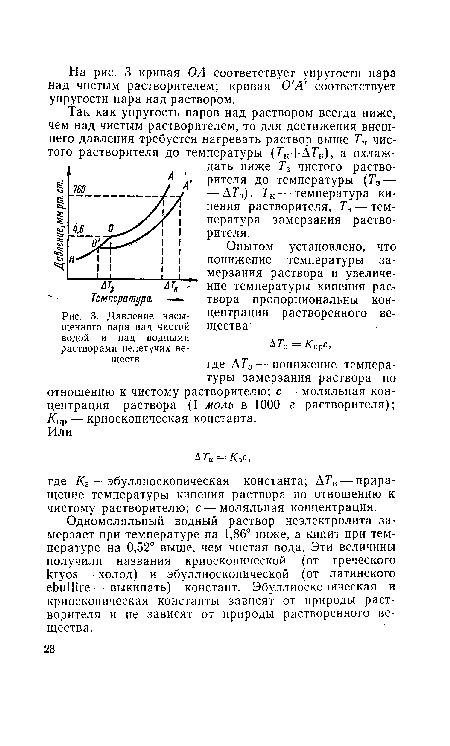
Уменьшение количества свободных молекул растворителя в растворе обусловливает явление осмоса и уменьшение упругости пара растворителя над раствором (по отношению к чистому растворителю).[ ...]
Явление осмоса наблюдается при соприкосновении двух растворов различной концентрации, разделенных полупроницаемой перегородкой (мембраной), пропускающей молекулы растворителя, но задерживающей молекулы растворенного вещества. Свободные молекулы растворителя проникают в более концентрированный раствор, увеличивая свою концентрацию в нем.[ ...]
Следовательно, осмос обусловлен стремлением молекул растворителя выравнять свою концентрацию по обе стороны мембраны. Осмос количественно характеризуется осмотическим давлением. Осмотическое давление равно тому внешнему гидростатическому давлению, которое необходимо приложить к системе для того, чтобы осмос прекратился.[ ...]
Согласно этому уравнению, одномоляльный раствор недиссоциирующего вещества обладает при 0° С осмотическим давлением 22,4 атм (я = 1 • 0,082 • 273 = 22,4).[ ...]
Закон Вант-Гоффа: все разбавленные растворы проявляют осмотическое давление, численно равное тому газовому давлению, которое оказывало бы растворенное вещество, если бы оно находилось в газообразном состоянии и занимало бы объем, равный объему раствора.[ ...]
Явление осмоса играет большую роль в практике. Свойствами полупроницаемое™ обладает большинство тканей организмов. Процессы усвоения пищи, обмена веществ тесно связаны с различной проницаемостью тканей для воды и тех или иных растворенных веществ. Явлением осмоса обусловлено то, что пресноводные бактерии и рыбы не могут жить в морской воде, а морские— в пресной.[ ...]
Рисунки к данной главе:
| Давление насыщенного пара над чистой водой и над водными растворами нелетучих веществ |
 |