Большинство металлов в результате воздействий атмосферных или химически активных веществ более или менее быстро разрушается. Процесс разрушения металлов протекает значительно быстрее, если воздух загрязнен промышленными газами, которые обычно содержат окислы азота, сернистый газ, пары кислот и т. п. вещества.[ ...]
Разрушение металла, происходящее в результате атмосферных воздействий, либо химически активных веществ, либо, наконец,. I в результате электрохимических процессов, называется коррозией. Наиболее распространенным и известным частным видом коррозии является ржавление железа.[ ...]
В результате коррозии ежегодно выходит из строя громадное количество металла, хотя на борьбу с ней и тратятся большие средства. Количество железа, ежегодно погибающего от коррозии во всех странах мира, составляет 40% добываемого количества.[ ...]
Изучению явления коррозии посвящено большое количество работ и для его объяснения предложено много теорий. Некоторые из этих теорий объясняют процесс коррозии химическими реакциями, другие — электрохимическими процессами.[ ...]
В доказательство правильности этой теории ее сторонники указывали на ускорение процесса ржавления железа в присутствии углекислоты и на сильное его замедление в щелочной среде.[ ...]
За последнее десятилетие процесс коррозии изучался Акимовым, по данным которого процессы коррозии по физико-химическим признакам можно разделить на две группы: коррозию химическую и коррозию электрохимическую. В обоих случаях процесс протекает в гетерогенной среде на границе металл—среда.[ ...]
В области электрохимической теории коррозии наиболее совершенными являются разработанные в XX в. фильмовая теория коррозии Кистяковского [1] и теория локальных или микроэлементов Акимова.[ ...]
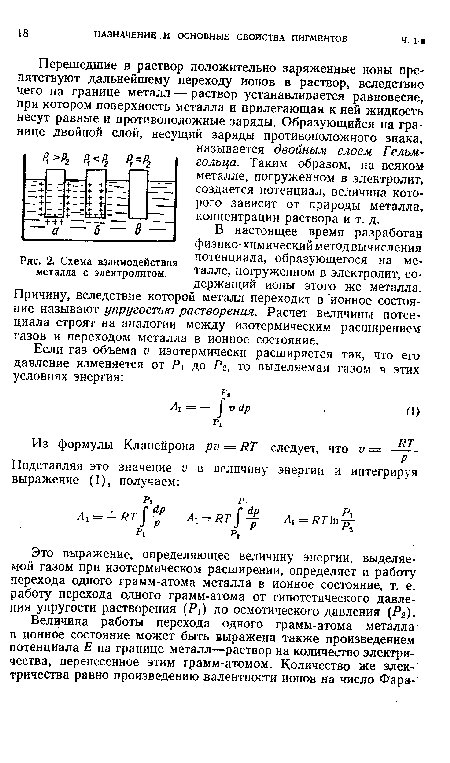
В настоящее время разработан физико-химический метод вычисления потенциала, образующегося на металле, погруженном в электролит, содержащий ионы этого же металла. Причину, вследствие которой металл переходит в ионное состояние называют упругостью растворения. Расчет величины потенциала строят на аналогии между изотермическим расширением газов и переходом металла в ионное состояние.[ ...]
Типичным примером коррозии металла, вследствие электрохимических процессов, является коррозия анода в гальванических элементах.[ ...]
Рисунки к данной главе:
| Двусторонняя диффузия Ме и О через пленку МеО (по Акимову). |
 |
| Схема взаимодействия металла с электролитом. |
 |
| Растворение цинка в серной кислоте по Де ла Риву. Справа показано направление тока в растворе. |
 |
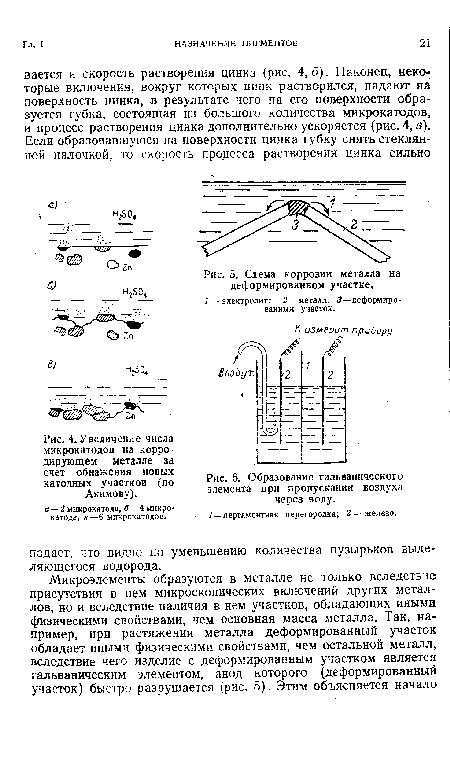
| Увеличение числа микрокатодов на корродирующем металле за счет обнажения новых катодных участков (по Акимову). |
 |
| Схема коррозии металла на деформированном участке. |
 |
| Образование гальванического элемента при пропускании воздуха через воду. |
 |