Как неорганические соединения азота, так и органические основания могут сорбироваться из сточных вод ионообменными смолами. Ниже будут рассмотрены особенности поглощения ионов аммония и пиридиния из сточных вод различными катионитами.[ ...]
По классификации Л. А. Кульского [32] ионообменную очистку применяют к сточным водам 4-ой группы, т. е. к водным растворам, содержащим загрязняющие вещества в ионной форме. Однако ионообменными смолами могут извлекаться из водных растворов и примеси 3-ей группы, способные в процессе контакта со смолами переходить в ионное состояние. Так, фенолы поглощаются анионитами в большей степени, чем активированными углями [33, с. 354]; пиридиновые основания сорбируются сильнокислотными и слабокислотными катионитами [34—36].[ ...]
Ионообменные смолы применяют в различных отраслях народного хозяйства, особенно в водоподготовке [37, 38] и цветной металлургии [39]. Поскольку ионообменные смолы — высокомолекулярные нерастворимые органические полимеры, обладающие функциональными группами, способными к обмену ионами с ионами раствора, то технологический процесс ионитной очистки слагается из следующих стадий: поглощение извлекаемых ионов из раствора— стадия очистки сточной воды; регенерация вещества из фазы ионита с помощью какого-либо регенерирующего агента; промывание ионита.[ ...]
Наибольшее внимание в литературе уделяется исследованию первой, основной и обычно самой простой, стадии процесса — поглощению и адсорбции. Стадии регенерации и промывки часто имеют решающее значение для внедрения процессов в промышленность и их экономики. Если в водоподготовке объемы растворов регенерации значительно меньше объема очищенной воды и поэтому их утилизация пока -не очень актуальна, то при очистке сточных вод они составляют 15—25% от объема очищенной воды. Очистка промышленных сточных вод и использование регенерируемых растворов должны решаться комплексно. Объем промывных вод должен быть минимальным с целью возможного приготовления из них растворов; регенерируемые растворы должны использоваться непосредственно в цехе или комбинате (что довольно трудно, так как объемы растворов сравнительно малы). При выборе регенерирующего агента нужно также учитывать возможность получения ценных, важных для народного хозяйства веществ. При очистке больших количеств производственных сточных вод вполне-реально совмещение процессов очистки сточных вод с ионообменным синтезом.[ ...]
Закономерности ионообменного синтеза, условия эффективного его проведения даны в монографии А. И. Вулиха [40]. Ионообменные процессы обладают определенной гибкостью; так, регенерацию аммиаксодержащих катионитов можно проводить различными кислотами, получая аммонийные соли.[ ...]
Обменные свойства ионитов характеризуются такими показателями: СОЕ — статическая обменная емкость; ДОЕ — динамическая обменная емкость; ПДОЕ — полная динамическая емкость; РОЕ — рабочая обменная емкость.[ ...]
Определяют СОЕ по различным методикам, часто длительным по времени. Однако известно, что скорость обмена у сильнокислотных катионитов и сильноосновных анионитов довольно высока, и основное количество вещества поглощается за небольшой отрезок времени (от 60 до 300 с) [41]. Поэтому для сравнительной оценки ионитов представляют интерес способы быстрого определения СОЕ.[ ...]
Ковдуктометрическое титрование набухшего в воде катионита раствором гидроксида основания довольно точно и быстро (1200— 1800 с) дает содержание активных групп в катионите [42]. Кон-дуктометрический метод применяют при изучении полноты обмена ионов и для определения коэффициентов диффузии ионов при ионообмене [43]. Изменения pH, электропроводности раствора, снятые во времени, подтверждают высокую скорость ионообмена в начальный период контакта ионита с раствором.[ ...]
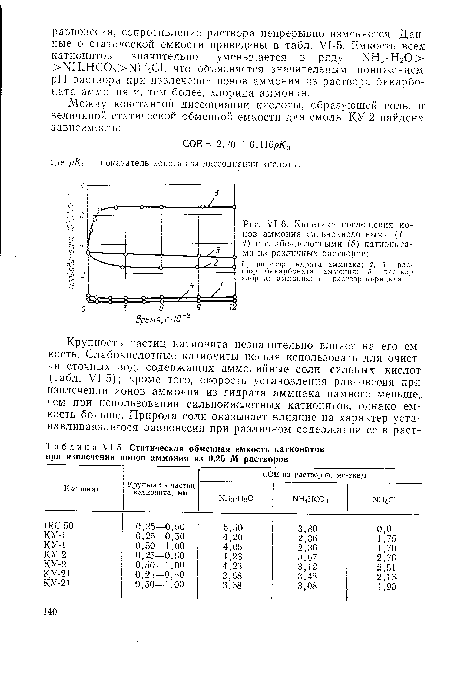
Авторами изучено поглощение аммиака, пиридина и карбамида из искусственных растворов и производственных сточных вод коксохимического завода и завода по производству карбамида. Статические обменные емкости определялись кондуктометрическим методом. Методика определения СОЕ сводилась к следующему. Навеска катионита (1 г) и 100 см3 испытуемого раствора помещались в кондуктометрическую ячейку, где они перемешивались с помощью магнитной мешалки. Сопротивление раствора периодически замерялось кондуктометром. Нарис. 71-6 представлены кривые изменения электропроводности раствора во времени при поглощении ионов аммония из водных растворов аммиака, бикарбоната аммония, хлорида аммония и пиридина. Различия в характере кинетических кривых объясняются особенностями испытуемых растворов.[ ...]
При извлечении ионов аммония из растворов гидрата аммиака или бикарбоната аммония образуются вода или слабая кислота, что приводит к уменьшению ионной силы раствора и, следовательно, к уменьшению его электропроводности. В случае хлорида аммония концентрация ионов в растворе остается неизменной, но ионы аммония заменяются более подвижными ионами водорода, что увеличивает электропроводность раствора.[ ...]
Рисунки к данной главе:
| У1-6. Кинетика поглощения ионов аммония сильнокислотными (1 — 4) и слабокислотными (5) катионитами из различных растворов |
 |
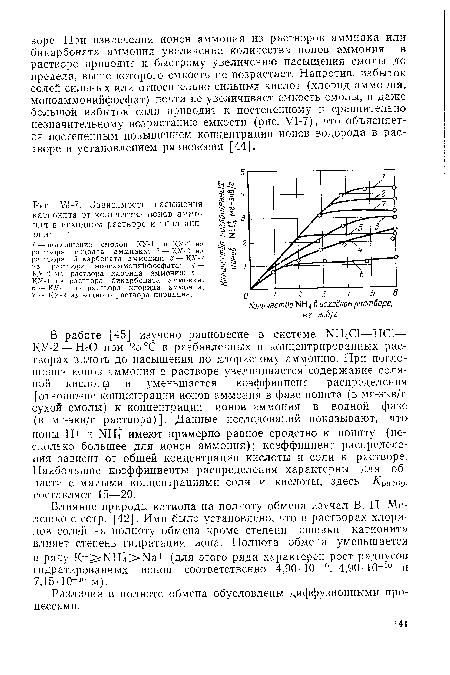
| Зависимость насыщения катионита от количества ионов аммония в исходном растворе и типа аниона |
 |
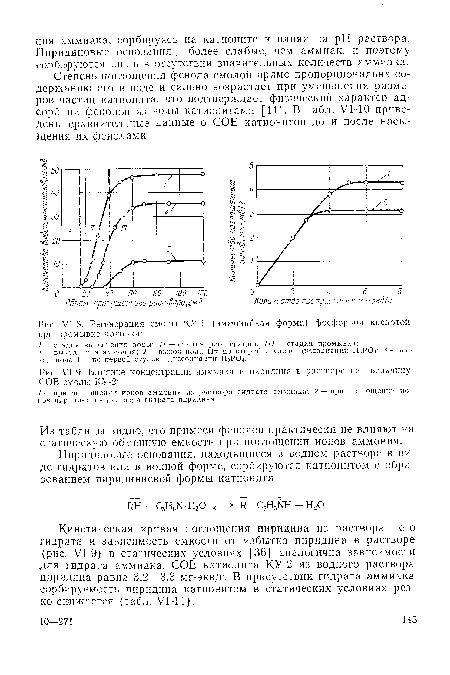
| П-8. Регенерация смолы КУ-1 (аммонийная форма) фосфорной кислотой при промывке колонки |
 |
| У1-9. Влияние концентрации аммиака и пиридина в растворе на величину СОЕ смолы КУ-2 |
 |
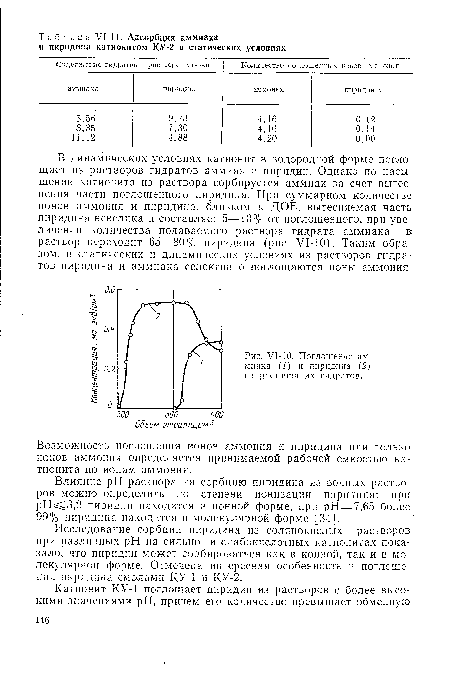
| У1-10. Поглощение аммиака (1) и пиридина (2) из раствора их гидратов. |
 |