Эти методы используют преимущественно для удаления летучих веществ, таких, как аммиак, цианистый водород, легколетучие органические основания. Десорбцию можно осуществлять при кипячении растворов, подаче в раствор острого пара, инертных газов, воздуха. Десорбция возможна в искусственных сооружениях и в естественных условиях из воды водоемов или биологических прудов.[ ...]
Закону Генри удовлетворительно подчиняются низкоконцентрированные растворы, в которых физически растворены газы и пары. При химическом взаимодействии давление пара летучего компонента значительно снижается и определяется количеством вещества в гидролизованной форме; в этом случае в формулу, определяющую давление десорбируемого компонента, вместо общей концентрации компонента подставляют концентрацию гидратированного компонента х (в мол. долях).[ ...]
Давление насыщенных паров легколетучего компонента над жидкостью определяют на основании данных о свойствах чистых компонентов, составляющих систему.[ ...]
Коэффициенты активности 71, 72 определяют экспериментально. Для некоторых систем коэффициенты активности даны или могут быть рассчитаны по справочным данным [8]. Для сточных вод, которые представляют собой довольно разбавленные растворы, с некоторой степенью погрешности можно использовать зависимости, справедливые для идеальных систем. Однако именно в области малых концентраций аммиак и пиридиновые основания имеют максимальные коэффициенты активности; степень отклонения зтиХ систем от свойств идеальных растворов была рассмотрена выше (см. гл. III).[ ...]
Значения при различных температурах и pH приведены в табл. VI-1.[ ...]
Из сказанного выше следует, что процесс десорбции может быть интенсифицирован при увеличении температуры. На десорбцию оказывает влияние и содержание десорбируемого вещества в аэрирующем агенте. Очистке подвергают достаточно разбавленные растворы, поэтому и содержание вещества в аэрирующем агенте должно быть близким к нулю.[ ...]
Для удаления аммиака и летучих органических оснований в промышленности чаще прибегают к десорбции при кипении раствора, предполагающей либо обогрев глухим паром, либо подачу в аппарат острого пара, что равноценно по воздействию.[ ...]
В гл. III были рассмотрены вопросы десорбции аммиака из растворов аммиака в воде (растворов, содержащих аммиак и диоксид углерода, а также из растворов солей аммония и слабых кислот или кислых солей многоосновных кислот). Более сложной оказывается десорбция аммиака из стоков, содержащих соли слабых и сильных кислот.[ ...]
Примером таких растворов является прежде всего надсмольная вода коксохимических производств, содержащая карбонаты, сульфиды и цианиды аммония, подвергающиеся полному гидролизу при температуре выше 60 °С (поэтому условно относимые к солям летучего аммиака), и хлорид аммония, роданид аммония, сульфат аммония, которые не претерпевают заметного гидролиза и не образуют летучих кислот (соли связанного аммиака).[ ...]
В связи с переработкой надсмольной воды на химических установках заводы УССР практически весь аммиак, содержащийся в надсмольной воде, переводят в сульфат аммония.[ ...]
Рисунки к данной главе:
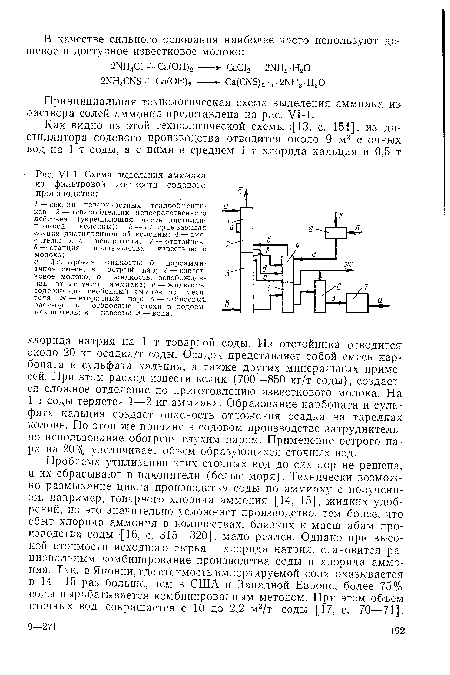
| Схема выделения аммиака из фильтровой жидкости содового производства |
 |
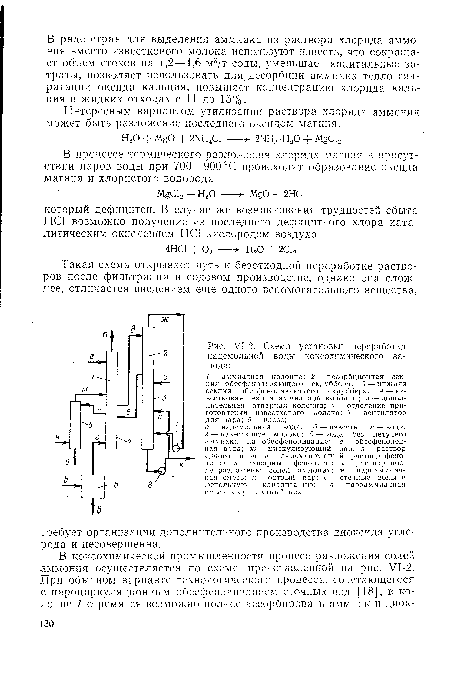
| Т-2. Схема установки переработки надсмольной воды коксохимического завода |
 |
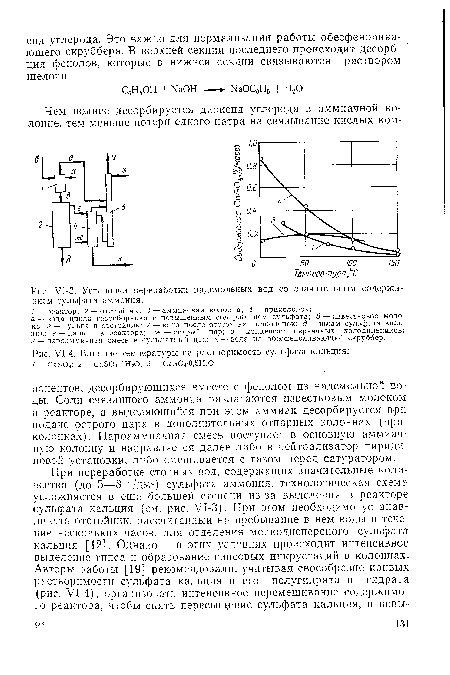
| У1-3. Установка переработки надсмольных вод со значительным содержанием сульфата аммония |
 |
| У1-4. Влияние температуры на растворимость сульфата кальция |
 |