Наиболее полно аммиак может быть извлечен из газов растворами сильных кислот с получением солевых товарных продуктов. При этом в качестве абсорбентов используют кислоты, образующие слабо гидролизующиеся или не гидролизующиеся соли (например, серную, азотную, в меньшей степени фосфорную кислоты). Мы не будем рассматривать процесс поглощения аммиака азотной кислотой, который является составным элементом производства одного из наиболее массовых азотных удобрений — нитрата аммония. Нейтрализацию при этом ведут, как правило, чистым аммиаком. Азотная же кислота для абсорбции аммиака из газов используется крайне редко, если не считать процессы производства карбамида по открытой схеме.[ ...]
Производству нитрата аммония посвящена обширная литература [49, 50].[ ...]
Солевая схема улавливания аммиака возможна в двух вариантах. Первый из них предполагает поглощение основной массы аммиака водой и использование кислоты только для доулавливания остатков аммиака. Такое решение позволяет полностью извлекать аммиак из газа и частично оставлять его в воде, циркулирующей в системе на стадии регенерации. При этом расход кислоты незначителен, а получаемый раствор соли должен использоваться на данном предприятии или близлежащих промышленных и сельскохозяйственных предприятиях. Так, например, при доулавлива-нии аммиака раствором серной кислоты из выбросов производства карбамида получаемый раствор сульфата аммония может быть добавлен в плав карбамида для увеличения прочности гранул [52]. Раствор фосфатов аммония, получаемый при очистке от аммиака отходящих газов производства сложных удобрений, добавляют в аппарат для грануляции. Раствор фосфатов аммония, получаемый при извлечении аммиака из выхлопных газов на крупном химическом предприятии, может быть использован и в качестве жидкого удобрения на близлежащих сельскохозяйственных предприятиях и в тепличных хозяйствах.[ ...]
Этот вариант не связан с осуществлением сложных технологических приемов производства товарных солей, а капитальные затраты и энергозатраты незначительны.[ ...]
Другой, более сложный, вариант предусматривает улавливание кислотой всего избыточного аммиака и организацию производства товарных солей, а следовательно, строительство и эксплуатацию комплекса необходимых технологических и складских сооружений.[ ...]
Использование фосфорной кислоты для улавливания аммиака довольно заманчиво, так как при этом получают фосфаты аммония— концентрированные сложные удобрения, имеющие общее содержание питательных веществ около 75% (по сравнению с 20,5—21,0% у сульфата аммония), которые могут найти и другое применение [53—55]. Широкое применение фосфорной кислоты ограничивается ее дефицитностью и высокой стоимостью. Однако и стоимость продуктов превращения фосфорной кислоты также высока, поэтому производство их оказывается рентабельным.[ ...]
Для очистки газов можно использовать либо термическую фосфорную кислоту, либо экстракционную, свободную от фтора и полуторных окислов. Такие фосфорные кислоты производят в недостаточных количествах, транспортируют только в специальных цистернах и хранят в футерованных емкостях. Поэтому применение очистки фосфорной кислотой оправдано на предприятиях, использующих в производстве фосфорную кислоту, или при возможности кооперации с находящимися поблизости аналогичными предприятиями.[ ...]
Выбор аппаратуры определяется свойствами получаемой соли. Так, в производстве сульфата аммония или моноаммонийфосфата, над водными растворами которых даже при небольшом избытке кислоты давление аммиака равно нулю, можно использовать любые аппараты (противоточные и циркуляционные), обеспечивающие достижение одной теоретической ступени массопередачи.[ ...]
Рисунки к данной главе:
| Ш-21. Сатураторная схема улавливания аммиака с получением солей |
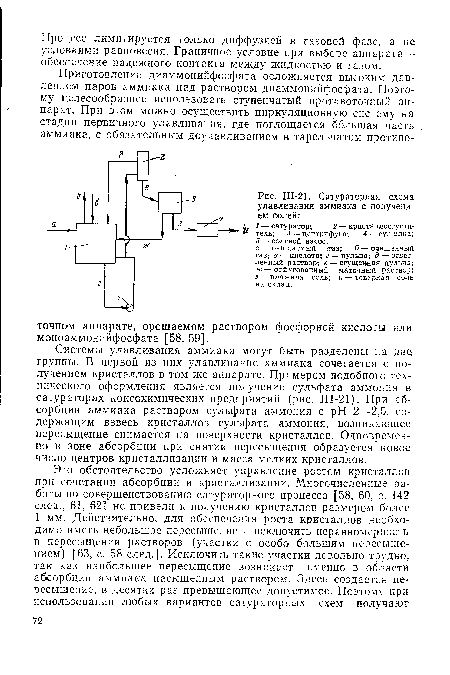 |