Существуют два принципиально различных метода измерения pH растворов: колориметрический и электрометрический.[ ...]
Колориметрический метод измерения pH, как и колориметрическое титрование, основан на свойстве определенных веществ (индикаторов) менять свой цвет в зависимости от значения pH раствора, к которому они добавляются. Окраску сравнивают с цветом того же индикатора в растворе с известным pH. Этот метод удобен для качественной оценки и ориентировочных количественных разовых измерений pH в производственных условиях.[ ...]
Ей— нормальный, или стандартный, электродный потенциал; т. е. потенциал электрода при активной концентрации его ионов в растворе, равной единице.[ ...]
Для металла с валентностью более единицы второй член правой части уравнения (1.7) следует разделить на его валентность.[ ...]
Из уравнения (1.7) видно, что потенциал, возникающий на электроде, пропорционален логарифму концентрации ионов металла. Уравнение это справедливо для электродов не только металлических, но и водородных, применявшихся на первом этапе развития рН-метрии.[ ...]
Потенциал так называемого нормального водородного электрода, по отношению к которому определены потенциалы всех других электродов, условно принят равным нулю.[ ...]
За последнее десятилетие потенциометрический метод измерения pH благодаря удобству и точности получил широкое применение как в исследовательской практике, так и в технике, почти совершенно вытеснив колориметрический метод. Этому способствовало появление стеклянного электрода и совершенных измерительных устройств, позволяющих измерять э. д. с. при сопротивлении цепи в несколько сотен мегом. Стеклянный электрод является наиболее универсальным, так как дает возможность измерять в широком диапазоне активность водородных ионов в растворах практически любого химического состава, и в том числе содержащих органические окислители и восстановители. Исключение составляют лишь растворы, содержащие соединения фтора. Свойства стеклянного электрода хорошо изучены экспериментально, но строгого теоретического обоснования пока еще не получили. В настоящее время наиболее обоснованными считаются теории Б. П. Никольского и М. Дола [4, 5]. Стеклянный электрод отличается от других электродов тем, что его потенциал возникает не вследствие окислительно-восстановительных процессов, а, вероятнее всего, в результате диффузионных явлений, протекающих на границе фаз.[ ...]
Обычно стеклянный электрод представляет собой тонкостенный шарик на конце толстостенной трубки (рис. 1.1).[ ...]
Шарик сделан из стекла с большим содержанием натрия или лития и залит раствором с постоянным известным значением рНг. Для снятия потенциала с внутренней поверхности стекла в стеклянный электрод вставляется вспомогательный электрод (платиновая проволока). В качестве второго электрода (сравнения) применяется каломельный или хлоросеребряный электрод. В сущности каждый стеклянный электрод представляет электрическую цепь из двух пограничных слоев, образованных стеклянной мембраной (стенкой шарика).[ ...]
В заключение отметим еще одно свойство стеклянного электрода. Если величина pH раствора, залитого во внутреннюю полость электрода, равна pH раствора, омывающего внешнюю поверхность шарика, то, хотя согласно последнему уравнений э. д. с. в этом случае должна быть равна нулю, на активных поверхностях электрода возникает разность потенциалов, достигающая 10 мв и более. Эта разность потенциалов получила название потенциала асимметрии. Его появление объясняют различием в свойствах внешней и внутренней поверхностей шарика, возникшим из-за неодинаковых условий охлаждения поверхностей электрода при его изготовления. Величина потенциала асимметрии увеличивается с утолщением стенки шарика электрода и зависит от состава стекла. Для компенсации потенциала асимметрии в схемах рН-метров обычно вводится дополнительное регулируемое напряжение. Кроме того, стабилизация и некоторое уменьшение ’потенциала асимметрии достигается путем ¡предварительного вымачивания электродов в ОД н. растворе соляной кислоты .в течение 7—10 дней.[ ...]
Рисунки к данной главе:
| Измерительная пн. тема со стеклянным электродом" |
 |
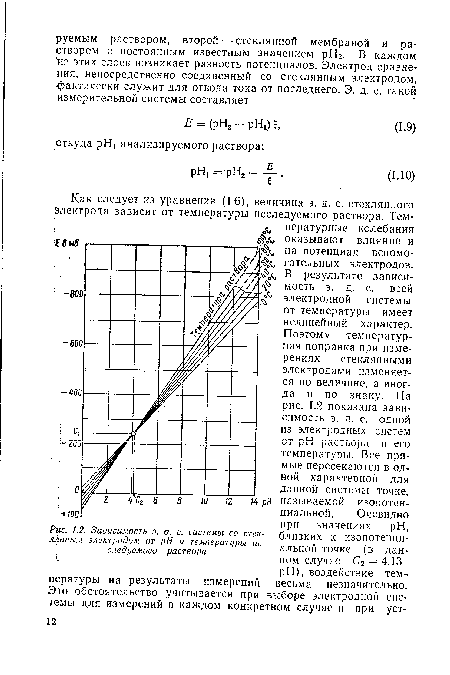
| Зависимость э. д. системы со стеклянным электродом от pH и температуры исследуемого раствори |
 |