Как уже указывалось выше, интенсивность цветения озер может быть замедлена путем снижения количества поступающих в них питательных веществ. В настоящее время большое внимание уделяется уменьшению поступления фосфора, так как считается, что осуществление контроля над процессом эвтрофикации водоемов зависит в основном от снижения концентрации этого питательного вещества. Однако не менее важно то, что удалять из сточных вод азотосодержащие соединения намного труднее. В некоторых штатах были приняты нормы на содержание фосфора в очищенных сточных водах. В этих стандартах указаны предельно допустимые концентрации фосфора в очищенных сточных водах, а также требования относительно удаления определенной части фосфора в процессе очистки. Предельно допустимые концентрации фосфора принимаются равными 1—2 мг/л (в большинстве случаев 1,0 ,мг/л), а эффективность удаления фосфора в процессе очистки должна составлять по нормативным требованиям 80—95%.[ ...]
Одна из самых ранних попыток контролировать содержание фосфора в сточных водах заключалась в том, чтобы найти заменители фосфорных компонентов в моющих средствах (детергентах). В то время такой подход считался вполне целесообразным, так как именно детергенты были основным источником фосфора, содержащегося в бытовых сточных водах. К сожалению, подходящего заменителя найти не удалось. Каустические добавки не имели равноценных моющих свойств, оказывали раздражающее действие на кожу, а некоторые их разновидности вызывали повреждения глаз и слизистых оболочек при вдыхании или попадании в рот. Нитрилотриацетат натрия (ЫТА), считавшийся наилучшим заменителем фосфатов, создавал угрозу для здоровья людей. Главный хирург США предложил, чтобы в течение еще некоторого времени домашние хозяйки продолжали пользоваться фосфатными детергентами ввиду их безопасности. Другое обстоятельство, выявленное в процессе дискуссии о фосфатных детергентах, заключалось в том, что эвтрофикация водоемов не является общенациональной проблемой. Выяснилось, что сточные воды из канализационных систем, обслуживающих приблизительно 55% населения, сбрасываются в океан или в ¡крупные реки, впадающие в океан. Еще 30% населения проживает в сельской местности, лишенной канализационной сети. Таким образом, в озера, которым может угрожать процесс эвтрофикации, сбрасываются сточные воды из канализационных систем, обслуживающих только 15% населения США. К таким водоемам относятся Великие озера, р. Потомак и ее эстуарий, залив Сан-Франциско и впадающие в него реки, оз. Тахо и много других больших и малых озер и водохранилищ. Считается, что фосфаты не представляют собой серьезной угрозы для рек. В пользу такой точки зрения говорят собранные данные, по которым даже такие высокие концентрации фосфора, как 2—3 мг/л, в движущихся водах не приводят к их серьезной деградации.[ ...]
Фосфаты и неорганический азот выводятся из раствора при фотосинтезе водорослей. Однако доказано, что выращивание и сбор водорослей для удаления из сточных вод питательных веществ представляют собой сложную в экономическом отношении задачу. Трудности, возникающие в связи с поддержанием требуемых отношения углерода к азоту и фосфору, значения pH и температуры, интенсивность солнечного освещения, невозможность отвода больших земельных участков для обеспечения требуемой длительности пребывания и высокая стоимость механизмов для сбора водорослей — все это служит препятствием к практическому использованию фотосинтеза для удаления питательных веществ.[ ...]
Молярное отношение А1 к Р равно 1:1, а весовое отношение поступающих в продажу квасцов к фосфору равно 9,7:1. Исследования процессов коагуляции показали, что для осаждения фосфора из сточной воды необходимо количество квасцов, превышающее стехиометрическое. Одна из конкурирующих реакций, частично объясняющая избыточную потребность в квасцах, — это реакция с веществами, обусловливающими естественную щелочность. Снижение содержания фосфора на 75, 85 и 95% требует соответственно весового отношения квасцов к фосфору приблизительно 13:1, 16:1 и 22:1. Для достижения 85%-наго удаления фосфора из сточной воды с концентрацией фосфора 10 мг/л необходимая дозировка квасцов составит 16X10=160 мг/л, что значительно выше того количества, которое используется для коагуляции воды, предназначаемой для поступления в городскую водораспределительную сеть.[ ...]
Железосодержащие коагулянты также приводят к осаждению фосфатов. Ионы трехвалентного железа образуют соль РеР04 при молярном отношении, равном 1:1. Так же, как и в случае с алюминием, для действительной коагуляции требуется большее количество железа, чем следует из уравнения химической реа/кции. В связи с тем, что реакция хлорного железа с веществами, обусловливающими естественную щелочность, протекает относительно медленно, вводится также известь или какая-либо другая щелочь для повышения pH и увеличения концентрации гидроксильных ионов. Механизм химической реакции, происходящей между ионами двухвалентного железа и фосфатом, не совсем ясен. Хотя сульфат железа (II) может приводить к образованию выпадающего в осадок фосфата при молярном отношении Ре:Р = 3:2, результаты экспериментов показывают, что здесь молярное отношение почти такое же, как при использовании солей трехвалентнаго железа. В продажу поступают такие соли железа, как сульфат железа (III), хлорид железа (III), сульфат железа (II) и отработанный травильный раствор со сталеплавильных заводов. При условии, что в сточной воде присутствуют в достаточном количестве вещества, обусловливающие высокую естественную щелочность, введение солей трехвалентного железа без вспомогательных коагулянтов приводит к удалению фосфора при таких отношениях Ре:Р, как 1,8:1 или больше. Это эквивалентно введению РеС13 в концентрации приблизительно 100 мг/л. Состав травильного раствора непостоянен и зависит от применявшихся процессов металлообработки. Наиболее распространенная форма — сульфат железа (II), образующийся при травлении серной кислотой, но встречается также хлорид железа (II), получаемый при травлении соляной кислотой. Содержание железа в отработанных растворах колеблется от 5 до 10%, а свободных кислот—от 0,5 до 15%. Для получения хороших результатов при использовании травильных растворов необходимо добавление извести или едкого натра. Например, при первичном отстаивании для снижения концентрации общего фосфора на 30% и ВПК на 60% требуется около 40 мг/л железа, 70 мг/л извести и 0,5 мг/л полимерных добавок.[ ...]
При добавлении достаточного количества извести осаждающее умягчение продолжается с образованием гидроокиси магния. Для удаления основной фосфорной фракции требуется pH в диапазоне 9,5—11,5, При дозах извести в форме СаО, равных 150—300 мг/л, выводится 80—90% фосфатов из обычных бытовых сточных вод. Требуемое количество извести зависит главным образом от щелочности, концентрации фосфора и требуемой степени удаления последнего.[ ...]
Производственные испытания показали, что квасцы и соли трехвалентного железа могут использоваться для химической коагуляции в сочетании с аэрацией с активным илом. По этой технологии коагулянт добавляют к аэрируемой смешанной жидкости или к жидкости, выходящей из аэротенка перед вторичным отстойником. Хотя в таком химико-биологическом иле находится меньшее количество простейших, это не оказывает отрицательного влияния на эффективность снижения БПК. Добавляемые химические вещества увеличивают объем избыточного ила приблизительно на 50%. Там, где этого требуют нормативы на качество очищенных сточных вод, их отфильтровывают перед выпуском для удаления мелких хлопьев.[ ...]
Химическое осаждение может также применяться в ■качестве третичной очистки, проводящейся непосредственно за вторичной биологической обработкой (см. рис. 14.4). Схема обработки напоминает схему очистки воды на водоочистных установках, включающую в себя быстрое смешивание, флокуляцию, седиментацию и фильтрование. Основное преимущество третичной обработки — разделение химического и биологического осадков, что позволяет более экономично проводить их ликвидацию. На оз. Тахо восстановление извести путем рекальцинирования в многоподовой печи оказалось экономически целесообразным только в отношении известкового осадка, получаемого при третичной обработке, не содержащего в значительном количестве органических веществ.[ ...]
Источниками азота, присутствующего в городских стачных водах, являются испражнения людей, перемолотый мусор и производственные стоки, особенно с предприятий пищевой промышленности. Приблизительно 40% азота находится в сточных водах в виде аммиака и 60%—в виде органического азота при ничтожно малом количестве нитратов. Общее содержание азота в городских сточных водах колеблется от 4 до 6 кг на 1 чел. в год. Традиционные механическая и биологическая очистки удаляют до 40% азота, находящегося в сточных водах.[ ...]
Нитрификация-денитрификация по двухступенчатой схеме, которой предшествует биологическая очистка, обеспечивает при расчетных расходах сточных вод снижение неорганического азота на 90% и общего азота на 80—95%. Преимущества биологического удаления азота заключаются в том, что в результате процесса нитрификации может быть достигнута требуемая степень удаления аммиака (если возникает необходимость, впоследствии проводят денитрификацию). Кроме того, такую систему можно приспособить в качестве дополнения к существующей системе биологической очистки.[ ...]
Рисунки к данной главе:
| Схема физико-химической обработай сточной воды (представлены различные процессы, используемые для получения требуемой степени очистки) |
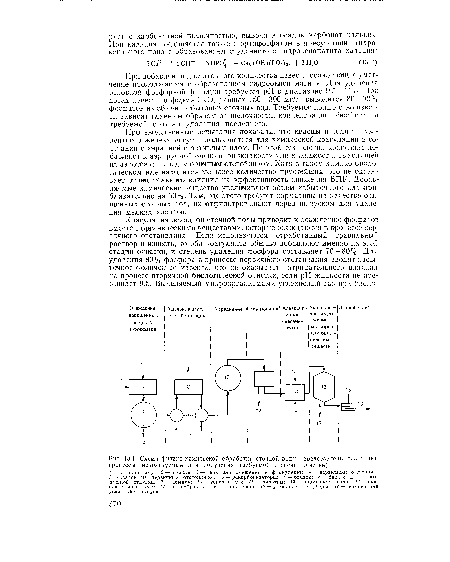 |
| Трехстуттен чатая система биологической обработки сточных вод с удалением азота и фосфора фильтрами доочистки |
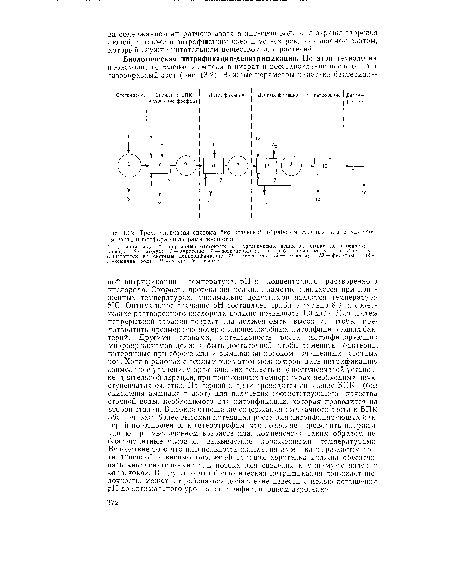 |