Основным методом производства очищенного сульфата алюминия в настоящее время является получение его из гидроксида алюминия. Большое распространение этого метода обусловлено относительной его простотой, . возможностью получения высококачественного продукта с незначительным содержанием оксидов железа, а также пониженными транспортными расходами.[ ...]
Гидроксид алюминия является полупродуктом в производстве глинозема. Его получают преимущественно из высококачественных бокситов щелочным способом Байера. В меньших количествах в нашей стране производят глинозем из нефелинов спеканием их с известняком, а также из алунитов щелочно-восстановительным способом.[ ...]
Гидроксид алюминия — мелкокристаллический порошок белого цвета, иногда с оттенками розового, серого и других цветов — выпускается двух марок: ГДО и ГД1. Минералогически он представлен в основном гидраргиллитом. В качестве примесей могут присутствовать незначительные количества алюмосиликатов.[ ...]
В зависимости от pH реакционной среды могут образовываться либо кислый сульфат алюминия — в случае избытка кислоты, либо основные сульфаты алюминия — в случае ее недостатка. Образование кислых солей нежелательно, так как это приводит к повышенному содержанию свободной серной кислоты в продукте, тогда как в соответствии с требованиями ГОСТа оно не должно превышать 0,05 %.[ ...]
При исследовании кинетики растворения гидроксида алюминия в интервале температур 60—100 °С десятикратным избытком серной кислоты концентрацией 15—35 % Бондарь показано, что скорость и степень растворения возрастают с увеличением концентрации кислоты и температуры процесса. Так, при взаимодействии с 15 %-ным раствором серной кислоты в течение 0,25 ч при 100 °С в раствор переходит 43 % оксида алюминия, с 25 %-ным раствором — 85 %, а с 35 %-ным раствором кислоты гидроксид алюминия растворяется полностью. При неполном растворении в осадке остается гиббсит. Энергия активации реакции взаимодействия гидроксида алюминия с серной кислотой составляет 87,4 кДж/моль.[ ...]
С увеличением температуры и концентрации серной кислоты до определенного значения при стехиометрической ее дозировке и длительности процесса 0,5 ч количество растворившегося гидроксида алюминия возрастает. Причем, если с повышением температуры [60] все кривые (рис. 2.5) резко поднимаются, то при увеличении концентрации кислоты наблюдается сдвиг максимума в сторону более высоких концентраций. Так, если максимальное количество прореагировавшего гидроксида алюминия при 100 °С составляет 72,5 % и приходится на концентрацию серной кислоты 35 %, то при 110—120 °С максимум отмечается в интервале концентраций 45—50 % и составляет 90—98 %. Однако повышать температуру выше точки кипения растворов нецелесообразно из-за значительного усложнения аппаратурного оформления процесса в связи с необходимостью применения автоклавов. Уменьшение количества прореагировавшего гидроксида алюминия при дальнейшем увеличении концентрации серной кислоты, по-видимому, объясняется увеличением вязкости суспензии, что приводит к снижению скорости диффузионного переноса ионов в этой реакции.[ ...]
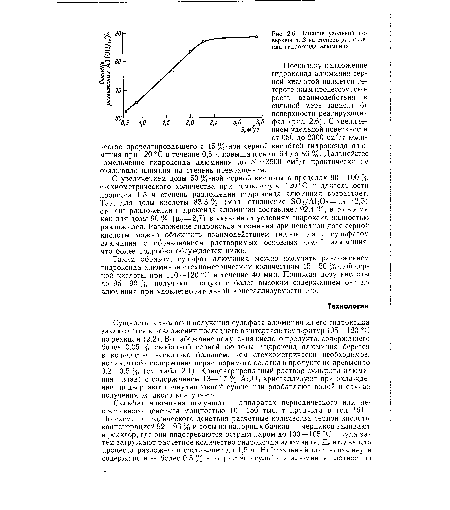
Поскольку разложение гидроксида алюминия серной кислотой является гетерогенным процессом, скорость взаимодействия в сильной мере зависит от поверхности реагирующих фаз (рис. 2.6). С увеличением удельной поверхности от 650 до 2300 см2/г количество прореагировавшего с 45 %-ной серной кислотой гидроксида алюминия при 120 °С в течение 0,5 ч повышалось от 63 до 86 %. Дальнейшее измельчение гидроксида алюминия до 5 — 3500 см2/г практически не оказывало влияния на степень превращения.[ ...]
С увеличением дозы 50 %-ной серной кислоты в пределах 80—100 % стехиометрического количества при температуре 120°С и длительности процесса 1,5 ч степень разложения гидроксида алюминия возрастает. Так, для дозы кислоты 83,3 % (мол. отношение 503/А1203 = ло = 2,5) степень разложения гидроксида алюминия составляет 92,4 %, в то время как для дозы 90 % (цо = 2,7) в указанных условиях гидроксид полностью разложился. Разложение гидроксида алюминия при неполной дозе серной кислоты можно объяснить взаимодействием гидроксида с сульфатом алюминия с образованием растворимых основных солей алюминия, что более подробно обсуждается ниже.[ ...]
Таким образом, сульфат алюминия можно получать разложением гидроксида алюминия стехиометрическим количеством 45—50 %-ной серной кислоты при 110—120 °С в течение 40 мин. Понижая дозу кислоты до 95—90 %, получают продукт с более высоким содержанием оксида алюминия при удовлетворительной кристаллизуемости его.[ ...]
Рисунки к данной главе:
| Влияние удельной поверхности 5 на степень разложения гидроксида алюминия. |
 |
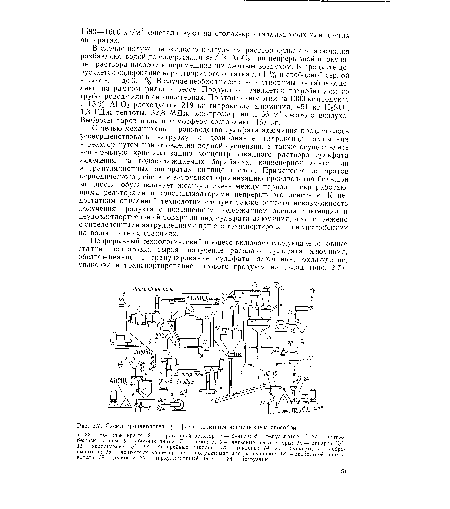
| Схема производства сульфата алюминия непрерывным способом |
 |