Образовавшиеся в процессе гидролиза коллоидные золи гидроксидов алюминия и железа коагулируют с образованием агрегатов и в конечном счете более или менее крупных хлопьев. Последние вместе с коллоидами, загрязняющими воду, осаждаются и, таким образом, очищают ее.[ ...]
Из уравнения (1.19) следует, что с увеличением константы гидролиза г равновесие смещается в сторону образования труднорастворимых гидроксидов алюминия и железа и гидролиз протекает более полно. Разбавление раствора, т. е. уменьшение концентрации коагулянтов, которое обусловливает понижение [К ], связывание ионов Н+ в недис-социированные молекулы и удаление образовавшегося гидроксида металла из зоны реакции, приводит к увеличению г.[ ...]
Из (1.21) следует, что концентрация водородных ионов в растворе будет увеличиваться с повышением температуры и дозы коагулянта, а также с уменьшением константы диссоциации образовавшегося гидроксида металла.[ ...]
Как следует из (1.22), степень гидролиза коагулянтов должна повышаться с увеличением температуры и значений pH дисперсной системы, разбавлением раствора (уменьшением дозы коагулянта) и уменьшением растворимости продуктов гидролиза — гидроксидов металлов.[ ...]
В разбавленных водных растворах в отсутствие комплексообразова-телей при рН<3 ион алюминия существует в виде комплекса [А1 (НгО) 1]3+ октаэдрической структуры [15, 16], в которой каждая из шести молекул воды первой координационной сферы связана водородными связями с двумя молекулами воды второй сферы [17]. Полная энергия гидратации иона алюминия 18 молекулами воды составляет около 4870 кДж/моль.[ ...]
Согласно данным ИК- и КР-спектроскопии [23] процесс дегидратации сопровождается полимеризацией путем сочленения мономеров оксо-мостиками aiAl С • Для четвертой ступени гидролиза (1.23) в разбавленных растворах рекомендовано как наиболее вероятное значение константы гидролиза p/Ci,4 9,4 [24].[ ...]
Константа димеризации [А1 (Н20)б (ОН)]2+ в 0,0007—0,059 М растворах алюминия, определенная потенциометрическим методом, равна 60 [26]. Константа образования димеров увеличивается с уменьшением ионной силы раствора ц, и при ¡¿ = 0 рДг.з 6,95 [27].[ ...]
Рентгеноструктурным анализом установлено, что структура димеров [А12(Н20)8(0Н)2]4+ состоит из двух октаэдров, соединенных по ребру [28]. В центре каждого октаэдра находится атом алюминия в окружении шести атомов кислорода.[ ...]
Полные константы гидролиза [А1(ОН)2]+, [А12(ОН)5] + и [А13(ОН)8] + равны соответственно 7,28-10 8, 1,23-10“12 и 6,31 -Ш-17.[ ...]
Рисунки к данной главе:
| Влияние pH раствора на распределение гидроксокомплексов алюминия |
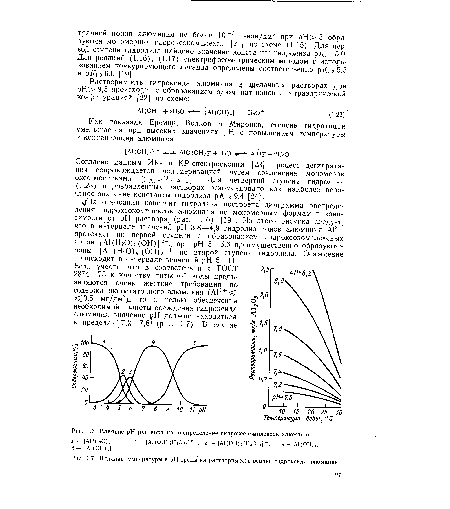 |
| Влияние температуры и pH среды на растворимость осадка гидроксида алюминия. |
 |
| Влияние pH раствора на распределение гидроксокомплексов железа (11) |
 |