Некоторые авторы указывают на меньший расход солей железа по сравнению с сульфатом алюминия [33, 35, 36], а также на их лучшую обесцвечивающую способность [34, 35].[ ...]
Результаты проведенных исследований указывают на преимущество солей железа при очистке мутных жестких вод с высокими значениями pH (например, паводочных вод) [40, 45—47], а также при обработке стоков [16, 48]. Это объясняется их способностью хорошо осветлять воду при более низкой остаточной щелочности и катализировать окисление органических примесей растворенным кислородом. Примесь титана не препятствует использованию солей железа, поскольку в ходе коагуляции концентрация Т14+ в воде уменьшается от значений, близких к 1 мг/л, до 0,04—0,085 мг!л [49, 50].[ ...]
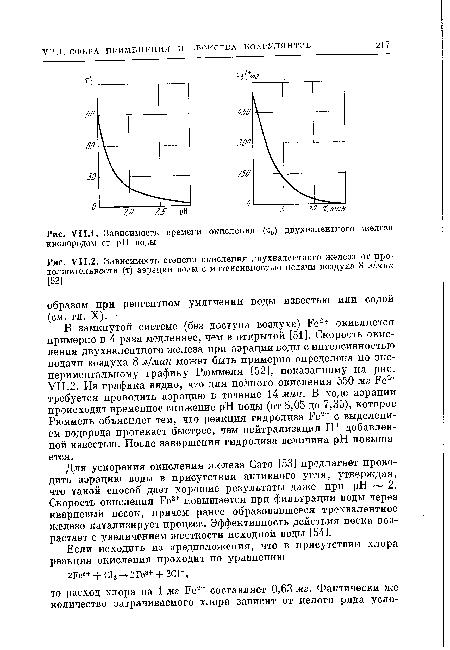
При коагулировании солями закисного железа главная технологическая задача состоит в заблаговременном переводе двухвалентного железа в трехвалентное. Окисление Ее2+ кислородом, содержащимся в воде, происходит медленно. Его скорость зависит от величины pH среды и достигает приемлемой для практических целей величины лишь при pH > 8 (рис. VII.1). Для интенсификации процесса окисления прибегают к подщелачиванию воды, ее перемешиванию, аэрации, обработке хлором.[ ...]
Для ускорения окисления железа Сато [53] предлагает проводить аэрацию воды в присутствии активного угля, утверждая, что такой способ дает хорошие результаты даже при pH 2. Скорость окисления Ре2+ повышается при фильтрации воды через кварцевый песок, причем ранее образовавшееся трехвалентное железо катализирует процесс. Эффективность действия песка возрастает с увеличением жесткости исходной воды [54].[ ...]
Аналогичным уравнением описывается скорость окисления железа кислородом [57].[ ...]
Выразив величину [Ге3+] через произведение растворимости гидроокиси железа или основной соли [Ре2304(0Н)4], Сысоева и др. получили уравнение зависимости константы скорости реакции от величины pH среды и доказали его соответствие результатам ранее проведенных экспериментов [58].[ ...]
Использование хлорированного железного купороса при обесцвечивании воды дает лучшие результаты по сравнению с другими солями железа. Однако в такие сезоны года, когда цветность исходной воды невысока, экономически выгоднее хлор заменять известью.[ ...]
Рисунки к данной главе:
| Зависимость времени окисления (т0) двухвалентного железа кислородом от pH воды |
 |
| УП.2. Зависимость степени окисления двухвалентного железа от продолжительности (т) аэрации воды с интенсивностью подачи воздуха 8 л!мин [52] |
![УП.2. Зависимость степени окисления двухвалентного железа от продолжительности (т) аэрации воды с интенсивностью подачи воздуха 8 л!мин [52]](/static/pngsmall/288985338.png) |