Важнейшая особенность лиофобных золей и суспензий, определяющая всю сумму наблюдаемых поверхностных явлений, состоит в существовании двойного электрического слоя ионов и скачка потенциала на границе раздела фаз. Причинами возникновения двойного электрического слоя являются разница в диэлектрических свойствах материала среды и дисперсной фазы, специфические молекулярные силы, обусловливающие избирательную адсорбцию ионов из раствора, или ионизация поверхностных молекул вещества самой дисперсной фазы.[ ...]
Распределение ионов вблизи поверхности раздела определяется действием противоположно направленных сил: сил молекулярного притяжения, удерживающих ионы у поверхности, сил электростатического притяжения или отталкивания и диффузионных сил, стремящихся выровнять концентрацию ионов в объеме среды.[ ...]
Строение двойного слоя можно представить схемой, показанной на рис. 1.7. Ионы, находящиеся в избытке на поверхности (называемые потенциалобразующими ионами), компенсируются противоионами. Часть ионов удерживается поверхностью на сравнительно близком расстоянии, порядка нескольких ангстрем, образуя так называемый плотный ионный слой. Остальные ионы образуют внешний диффузный слой, в котором в упорядоченное распределение ионов вмешиваются силы теплового движения. Под действием диффузии этот слой оказывается как бы «размытым» в направлении от поверхности раздела в глубину раствора. Заряд частицы обусловлен избытком ионов какого-либо одного знака в структурной геометрической единице слоя. Ионы, находящиеся в избытке, являются, таким образом, потен-циалопределяющими. Помимо ионов, в образовании двойного слоя участвуют молекулы, содержащие электрические диполи.[ ...]
Согласно выражению (1.16 ), величина га в зависимости от концентрации электролита может изменяться на несколько порядков — от нескольких ангстрем (концентрированные растворы) до сотен микрометров (разбавленные растворы).[ ...]
Каргин и др. [15—18] пришли к выводу, что потенциалопре-деляющим может быть катион водорода. Для этого случая строение частицы золя показано на рис. 1.8.[ ...]
Полный скачок потенциала ср0 между твердой частицей и точкой в глубине раствора называют поверхностным или термодинамическим потенциалом (рис. 1.9). В плотном слое, толщина d которого может быть определена как расстояние от центра тяжести зарядов внутренней обкладки поверхности до плоскости, проходящей через центры ближайших к поверхности противоионов (так называемой плоскости наибольшего приближения [8, стр. 197]), падение потенциала имеет линейный характер, а в диффузном слое из-за существования объемного заряда эта линейность нарушается.[ ...]
В зависимости от степени сродства вещества дисперсной фазы с окружающими его электролитами последние делятся на индифферентные и неиндифферентные. Потенциалопределящие ионы неиндифферентных электролитов способны повышать термодинамический потенциал частиц. С другой стороны, ионы противоположного знака, находящиеся с ними в паре, могут вызывать сжатие диффузного слоя и понижать тем самым ДП. При малых концентрациях неиндифферентного электролита обычно проявляется первая тенденция, происходит увеличение ср0 и £. При больших концентрациях на первый план выступает роль сопутствующих ионов: происходит снижение ДП вплоть до перемены знака на противоположный [1, стр. 292].[ ...]
Индифферентные электролиты не влияют на величину ф0, но сжимают двойной слой, уменьшая ДП.[ ...]
Рисунки к данной главе:
| Схема строения двойного электрического слоя на твердой поверхности |
 |
| Схема строения мицеллы гидроокиси железа |
 |
| Падение потенциала в двойном электрическом слое |
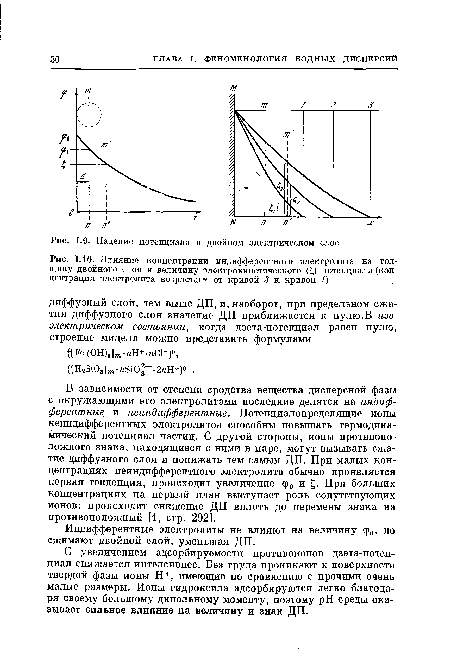 |
| Влияние концентрации индифферентного электролита на толщину двойного слоя и величину электрокинетического (£) потенциала (концентрация электролита возрастает от кривой 3 к кривой 1) |
 |
| Потенциальная кривая частицы золя |
 |
| Схема взаимодействия частиц |
 |
| Схема строения адсорбционного гидратного слоя у твердой поверхности (М —. N — граница поверхности) |
 |