Какие имеются основания считать, что кластерные, в частности гидратные, оболочки ионов могут задержать рекомбинацию? Со времени появления теории электролитической диссоциации известно, что именно это и случается в растворах, если теплота сольватации превосходит энергию, выделяющуюся при рекомбинации ионов. Нас интересуют, однако, не растворы, а газовое состояние вещества. О том, что оболочки из нейтральных молекул могут образовываться около ионов и в газовой фазе, ивестно уже давно. Ланжевен и Томсон более полувека назад обнаружили аномально низкую подвижность ионов в воздухе, приписав это тому, что они покрываются «шубой» нейтральных частиц, прочно связанной с ионами. Так впервые был введен термин кластер [49].[ ...]
Однако энергия связи (7, 18 эВ), выделяющаяся при этой реакции, так велика по сравнению с энергией связи последующих молекул воды, что удобнее говорить о гидратации иона Н30+, а не протона. В соответствии с этим мы часто будем писать формулы ионных гидратов протона в виде (Н30) + (Н20)п, а не Н+(Н20)Л.[ ...]
Появлению таких метастабильных состояний для систем из кластерных ионов в газовой фазе способствует то, что в отличие от растворов ионы разных знаков не находятся в постоянном контакте друг с другом. Конечно, при неупругих соударениях возможно образование нейтральных кластеров, в которых противоположно заряженные ионы, разделенные оболочками, связаны в одну частицу (см. рис. 4.1). Однако энергия связи таких больших образований, по-видимому, невелика и они, вероятно, легко распадаются при повышенной температуре.[ ...]
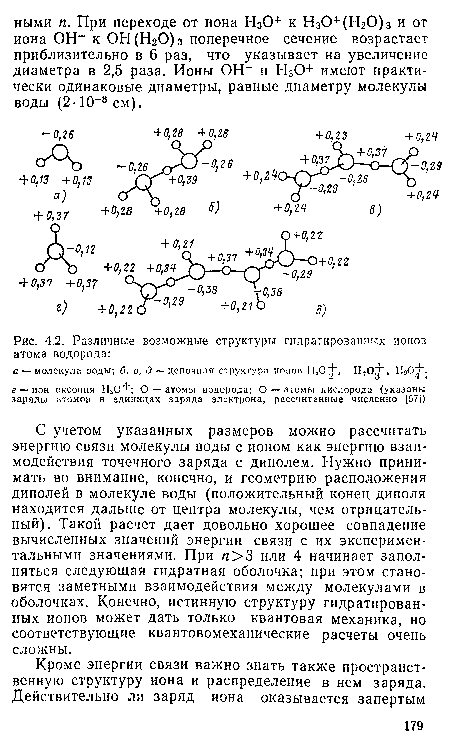
С учетом указанных размеров можно рассчитать энергию связи молекулы воды с ионом как энергию взаимодействия точечного заряда с диполем. Нужно принимать во внимание, конечно, и геометрию расположения диполей в молекуле воды (положительный конец диполя находится дальше от центра молекулы, чем отрицательный). Такой расчет дает довольно хорошее совпадение вычисленных значений энергии связи с их экспериментальными значениями. При п>3 или 4 начинает заполняться следующая гидратная оболочка; при этом становятся заметными взаимодействия между молекулами в оболочках. Конечно, истинную структуру гидратированных ионов может дать только квантовая механика, но соответствующие квантовомеханические расчеты очень сложны.[ ...]
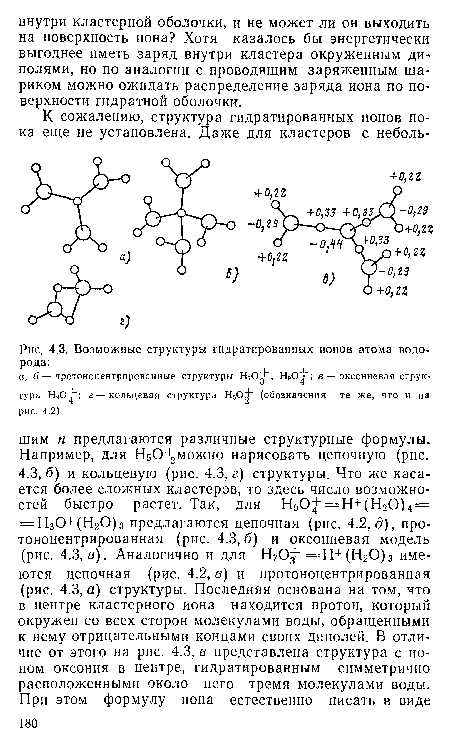
НдО+цепочная и оксониевая структуры одинаково выгодны энергетически, а протоноцентрированная модель имеет несколько меньшую энергию связи. Правда, энергетический выигрыш невелик (меньше 1 эВ). Как видно из рис. 4.2, цепочные структуры не вытянуты в прямую линию, но обнаруживают тенденцию к скручиванию, которая, вероятно, проявится сильнее в более сложных кластерах.[ ...]
Положение иона оксония не фиксировано на определенном месте поверхности додекаэдра. Его перемещение связано с так называемым туннелированием протона вдоль водородной связи. Речь, конечно, не идет о реальном туннельном эффекте для протона. Процесс сводится к замене водородной связи на валентную, приводящей к переходу протона в соседнюю молекулу. Как уже было упомянуто выше, каждый протон, находящийся на ребре додекаэдра, связан с двумя кислородными атомами: с одним — валентной, с другим — водородной связью. В силу симметрии системы эти связи могут меняться местами (переставляться). При такой перестановке избыточный протон, находящийся около одной из вершин, переходит к другой вершине, что связано с превращением молекулы воды, находящейся в этой вершине, в ион ок-синия. Частота таких перестановок оказывается порядка 1012 с-1, в то время как время разупорядочения за счет теплового движения рассматриваемой системы составляет 10 6 с. Таким образом, за время существования системы происходит приблизительно 106 актов туннелирования и ион оксония успевает много раз побывать во всех вершинах додекаэдра. Это приводит к размазыванию избыточного заряда по всей поверхности додекаэдра и минимизирует энергию системы, делая ее более устойчивой. Заметим, что все экспериментальные исследования проводились пока только в средах с очень низкой плотностью электрического заряда, т. е. в газах или в разреженной идеальной плазме.[ ...]
Рисунки к данной главе:
| Различные возможные структуры гидратированных ионов атома водорода |
 |
| Возможные структуры гидратированных ионов атома водорода |
 |