Раствор — гомогенная смесь, состоящая из растворителя и растворенного вещества. К растворителям относятся вода и ряд органических соединений: бензол, толуол, фенол, ацетон, дихлорэтан, спирты. Растворы могут состоять из двух, трех и более компонентов.[ ...]
Концентрацией раствора принято называть массовое количество растворенных твердых веществ в определенном массовом или объемном количестве раствора или растворителя (воды). В технике часто пользуются объемной концентрацией — массой растворенного вещества, кг, в 1 м3 раствора. Наряду с объемной концентрацией в практических расчетах применяется массовая концентрация, выраженная в массовых долях (или массовых процентах), т.е. в виде отношения массы растворенного твердого вещества к массе всего раствора.[ ...]
Растворение любого количества твердого вещества в воде ограничено. При заданной температуре раствор имеет определенную концентрацию насыщения, соответствующую установившемуся равновесию между растворившейся и оставшейся нерастворенной частью вещества.[ ...]
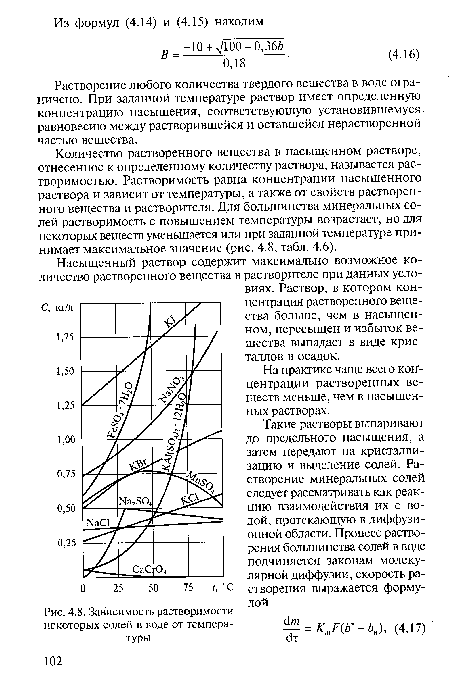
Количество растворенного вещества в насыщенном растворе, отнесенное к определенному количеству раствора, называется растворимостью. Растворимость равна концентрации насыщенного раствора и зависит от температуры, а также от свойств растворенного вещества и растворителя. Для большинства минеральных солей растворимость с повышением температуры возрастает, но для некоторых веществ уменьшается или при заданной температуре принимает максимальное значение (рис. 4.8, табл. 4.6).[ ...]
На практике чаще всего концентрации растворенных веществ меньше, чем в насыщенных растворах.[ ...]
Для применения формулы (4.18) необходимо иметь экспериментальные данные и, особенно, для значения К„„ зависящего от температуры раствора, скорости перемешивания и природы вещества.[ ...]
Значения или при 298 К (25 °С) для растворов многих солей приводятся в справочной литературе.[ ...]
Заметим, что приведенные формулы для определения плотности и удельной теплоемкости растворов в известной мере условны, поскольку составлены по правилу аддитивности.[ ...]
При необходимости выполнения точных расчетов можно использовать справочные данные или опытные величины, полученные для заданных растворов.[ ...]
Рисунки к данной главе:
| Зависимость растворимости некоторых солей в воде от температуры |
 |
| Зависимость плотности от концентрации растворов |
 |