В процессах хромирования электролиты загрязняются примесями металлов вследствие растворения материала деталей, а также ионами Сг3+ из-за нарушения соотношения анодной и катодной поверхностей. Повышение содержания примесных металлов существенно снижает удельную электропроводимость раствора электролита, приводит к уменьшению выхода по току, рассеивающей и кроющей способностей электролитов хромирования. Загрязнение электролитов ионами меди, железа, никеля, цинка и других металлов снижает антикоррозионные свойства хромовых покрытий. В случае использования саморегулирующихся электролитов, содержащих фториды или кремнийфториды, растворимость и накопление ионов посторонних металлов возрастает.[ ...]
Очистку электролитов хромирования от примесных металлов ионообменным методом проводят с помощью сильнокислотных катионообменных смол в Н-форме для связывания металлов и выделения в раствор эквивалентного количества ионов водорода. Однако, этот метод применим только для регенерации разбавленных электролитов с концентрацией СгОз до 100 г/л. При более высокой концентрации происходит деструкция смол с одновременным восстановлением Сг(У1) до Сг(Ш).[ ...]
Регенерированная хромовая кислота с концентрацией СгОз в пределах 50-60 г/л после частичного выпаривания направляется в ванны хромирования для корректировки электролита.[ ...]
Для регенерации электролитов хромирования с концентрацией СгОз 150-300 г/л целесообразно применять электрохимические методы регенерации. В большинстве случаев анодными материалами служат свинец, сплавы его с сурьмой, серебром и оловом, графит, титан, сталь, покрытая окисью свинца или марганца. Катоды изготавливаются из меди или нержавеющей стали. Так как реакции окисления и восстановления протекают почти с одинаковой скоростью, то для исключения попадания в катодную зону ионов Ст6 необходимо с помощью диафрагмы отделить катодное пространство от анодного, куда заливается раствор. Наиболее устойчивыми для этих целей являются специально изготавливаемые керамические и фторопластовые диафрагмы, а также из винипора, винипласта, пористого стекла. Диафрагмы должны обладать рядом технических свойств: химической стойкостью в агрессивных средах, низким электросопротивлением, достаточно высокой скоростью движения ионов, обеспечивающих протекание тока, и низкой скоростью перемещения других компонентов раствора, механической стойкостью, длительностью срока службы.[ ...]
Процесс протекает при температуре 40-60 °С, плотности анодного тока 3-4 А/дм2, катодного тока 17-20 А/дм2. Католитом служит раствор серной кислоты или смеси солей сульфатов и бисульфатов.[ ...]
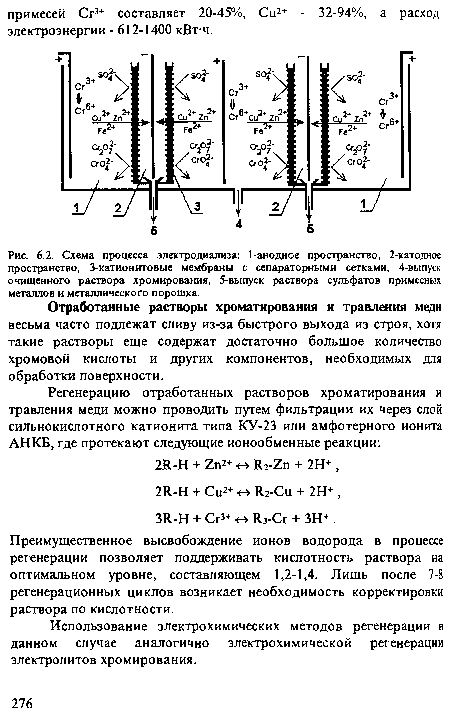
При использовании катионитовых мембран отработанные электролиты хромирования помещают в анодную камеру диафрагменного электролизера, а в катодную заливают 5 %-ный раствор серной кислоты или сульфата натрия, подкисленного серной кислотой. Это позволяет обеспечить практически полное удаление примесей Сг3+ и большей части (70-90 %) примесей железа, цинка, меди без снижения концентрации хромовой кислоты. Примеси металлов осаждаются в катодном пространстве в виде осадков гидроокисей или в виде рыхлого, порошкообразного, легко отделяемого осадка, частично осыпающегося с поверхности катодов. Схема процесса электродиализа показана на рис.6.2. Процесс ведут при катодной плотности тока 2,7-10 А/дм2 и объемной плотности тока 2,2-8 А/л. Расход электроэнергии на обработку 1 л электролита хромирования составляет 0,4-1,7 кВт-ч.[ ...]
Отработанные растворы хроматирования и травления меди весьма часто подлежат сливу из-за быстрого выхода из строя, хотя такие растворы еще содержат достаточно большое количество хромовой кислоты и других компонентов, необходимых для обработки поверхности.[ ...]
Преимущественное высвобождение ионов водорода в процессе регенерации позволяет поддерживать кислотность раствора на оптимальном уровне, составляющем 1,2-1,4. Лишь после 7-8 регенерационных циклов возникает необходимость корректировки раствора по кислотности.[ ...]
Рисунки к данной главе:
| Схема процесса электродиализа |
 |